论道医药专利 | 听美国律师说美国简化新药申请诉讼
作 者 | Christopher J. Sorenson
Partner, Merchant & Gould P.C.
翻 译 | 亚云 Bruce
(本文系知产力获得独家首发授权的稿件,译文版权为知产力所有,转载须征得作者本人同意,并在显要位置注明文章来源。)
(本文3105字,阅读约需6分钟)
在美国,食品药品管理局(“FDA”)负责对制药行业进行监管,包括仿制药品的批准。为了让人们更广泛地在市场上获取仿制药,同时还能鼓励原研药企业投入研发,美国国会颁布了一个法律准则,通常被称为《Hatch-Waxman法案》(21 U.S.C. § 355(j), 35 U.S.C. §§156, 271(e))。这一准则促进了美国境内市场独占与可能适用于任何特定药品的专利独占裁决之间的相互作用。
I Hatch-Waxman法案概述
在Hatch-Waxman法案下,寻求新药批准的实体(NDA申请人)必须确定应用于与产品相关的活性成分、配方和使用方法的专利,然后由FDA列入“橙皮书”。[1] 应NDA申请而批准药物后,FDA将授予该药物不受任何专利期限影响的市场独占权。有几种不同的市场独占(marketing exclusivity,或regulatory exclusivity,“监管独占”)可以适用——包括新化学实体(New Chemical Entity,NCE)独占、罕用药独占(Orphan Drug Exclusivity,ODE,又译“孤儿药独占”)以及其他独占。
NDA持有人与仿制药生产商之间关于专利独占的所有裁决,均交由美国联邦地区法院进行。从NCE独占期满前一年开始,仿制药生产商就可以提交一份简化新药申请(Abbreviated New Drug Application,ANDA),用于FDA批准仿制药产品。ANDA申请人务必向FDA证明其仿制药产品:(1)具有与该原研药相同的活性成分和基本药代动力学;(2)是生物等效的;(3)剂型和强度与原研药相同。Caraco Pharm. Labs., Ltd. v. Forest Labs., Ltd., 527 F.3d 1278, 1282 (Fed. Cir. 2008). ANDA申请人可以依靠来自原研药的临床数据来证明其产品的安全性和有效性,并且还能以比NDA持有者获得原研药批准更低廉的成本,加速获得FDA的批准。
为了解决所申请的仿制药引起的任何专利问题,仿制药公司必须在FDA橙皮书所列至少一个专利中附上一份“第四类”证明。这一证明是四种可以利用的证明之一[2],但也是唯一一种可能引起相应诉讼的证明。“第四类”ANDA证明相当于是人为挑战专利权的行为。AstraZeneca LP v. Apotex, Inc., 633 F.3d 1042, 1046 (Fed. Cir. 2010). 因此,即使没有发生任何实际销售ANDA产品的行为,法院也被允许确定仿制药产品是否会(如果获得批准)侵犯一件有效专利。Eli Lilly & Co. v. Medtronic, Inc., 496 U.S. 661, 678 (1990). 而NDA持有人(如果在专利诉讼中胜诉)申请的永久性禁令可以获得允准,从而禁止该药品在涉案专利到期前获得FDA的最终批准。Acorda Therapeutics, Inc., 817 F.3d at 760. 相反,首先申请并且申请成功的ANDA申请人,则作为唯一获批的仿制药,获得价值连城的180天市场独占期。Apotex Inc. v. Daiichi Sankyo, Inc., 781 F.3d 1356, 1360 (Fed. Cir. 2015).
尽管详细的程序并非本文要详述的范围,不过值得一提的是,如果原研药企业在Hatch-Waxman法案规定的时间范围内遵守了特定协议,那么最长可达30个月的ANDA申请批准自动暂缓期将会适用。Ortho-McNeil Pharm., Inc. v. Mylan Labs., Inc., 520 F.3d 1358, 1366 (Fed. Cir. 2008). 这样一来,专利诉讼的时间相对而言就会较短,因为地区法院级别的案件应当(最迟)会在NDA持有者收到橙皮书专利成为第四类证明对象的通知后的30个月内解决。这通常意味着大多数美国联邦地区法院会推行一个案件时间表,规定自通知信函发送至NDA持有人之日起18至24个月内进行审判,如下图所示:
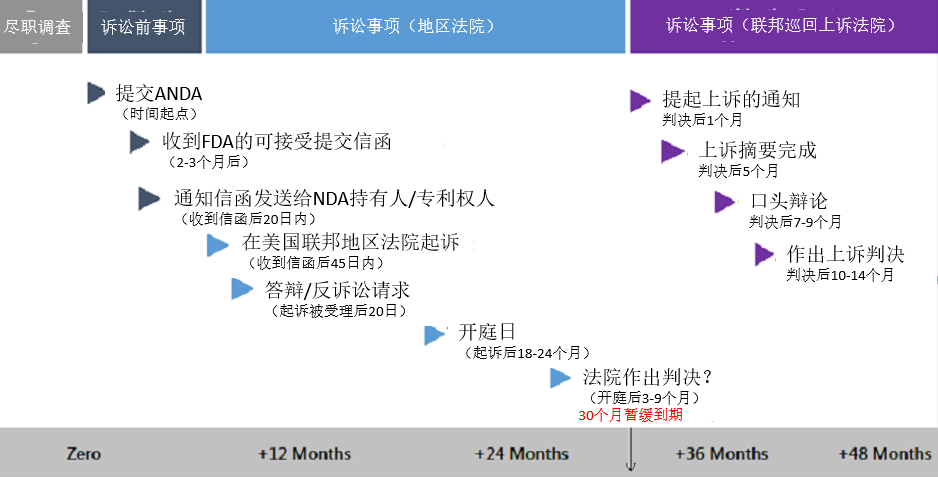
因此,Hatch-Waxman法案为在最终FDA批准仿制药之前解决与ANDA产品相关的专利纠纷提供了途径。这从原则上为避免原研药的市场份额受到损害提供了一种手段,并且消除了由于在准备ANDA申请期间仿制药生产商对该专利发明的生产、使用,而可能引起的巨额损害赔偿。
II 氨甲环酸——案例研究
Hatch-Waxman诉讼可能是复杂的,并且有可能引发关于专利法、民事程序、科学和FDA法规的很多潜在问题。有一个案例可以展示美国的ANDA诉讼过程中可能会涉及的许多反复考虑。Ferring B.V. v. Watson Labs., Inc., 764 F.3d 1401 (Fed. Cir. 2014) 一案体现了市场独占的竞争原则以及对于非常陈旧活性成分的新配方的专利保护限制。该案中,Hatch-Waxman法案不仅有助于迅速推出仿制版的药品,同时还能为开发该药品的原研药企业保持合理的市场独占期。
Lysteda®于2009年11月获得FDA的批准。它作为氨甲环酸(tranexamic acid)的速效片剂获批,其中的氨甲环酸是在欧洲被(数十年)用于治疗月经过多的活性成分。Ferring B.V. v. Watson Labs, Inc., 764 F.3d 1382, 1384 (Fed. Cir. 2014). FDA授予Lysteda数年的市场独占期,2012年到期。在Lysteda®最初获批后不久、该药品任何专利都未被列入橙皮书前,Watson提交了其ANDA,申请批准Lysteda®产品的仿制药。Ferring B.V. v. Watson Labs., Inc., 764 F.3d 1401, 1404 (Fed. Cir. 2014). Ferring随后[3]列出了三个专利,每个专利对应一种氨甲环酸的改良释制剂。Id. at 1403. 在Watson对FDA的每件专利提交了第四类证明,并且就这些证明发送通知给Ferring之后,Ferring于2011年7月在内华达地区法院提起了专利侵权诉讼。案件经过开示后,于2014年1月开庭审理,此时Watson的仿制药产品在美国已经销售了超过12个月,Ferring的市场独占已经过期,Watson的产品也已获得FDA的批准。
在Ferring主张的专利权利要求中,有一部分涉及药品中的氨甲环酸在水中易溶的特性。Id. Watson的ANDA规格标准没有包含关于最终产品在水中易溶特性的任何信息,但是Ferring辩驳道,为了支持ANDA申请而进行的一些实验测试显示,未包衣的ANDA片剂中间体在水中显示出落入专利权利要求范围内的溶解特性。Id. at 1410-11. Ferring还指出,Watson在诉讼期间进行的溶解测试表明,至少部分最终产品在水中表现出侵犯性的溶解数据。Id. at 1410.
内华达地区法院经过为期八天的审理后,认定ANDA产品侵犯了该专利,上诉被立即提起。联邦巡回上诉法院在上诉中撤销了原判,并指出ANDA申请只是出于管辖目的的“建设性”侵权行为,但Ferring应承担举证责任,证明所申请的ANDA产品会实际侵权。Id. at 1408. 联邦巡回上诉法院认为Ferring未能履行其举证责任,并指出只有最终获批剂形的ANDA产品才与该案相关。Id. at 1410. 联邦巡回上诉法院认定,在数百个结果表明不侵权的同时存在一些异常溶解结果,这样的证据不足以支撑Ferring的举证责任。Id. at 1409-10. 在由Ferring的专家实际测试过的数百个样本中,只有四个片剂的溶解落入了权利要求主张的溶解参数内。Id. at 1405. Watson的专家提供的证据表明,这些异常值包衣不足,并不能代表Watson的ANDA产品。Id. at 1409. 联邦巡回上诉法院认定,这四个异常片剂并没有证明侵权的证据优势。
联邦巡回上诉法院也没有完全采纳Watson中间体的实验性溶解数据,这些中间体并没有反映出有包衣、供出售的成品片剂的情况。Id. at 1410. 具有不到17kp的精确硬度的未包衣中间体内核,其溶解被认定为未落入权利要求溶解数据,并且经修改的ANDA要求Watson被FDA批准的氨甲环酸片剂的核心硬度小于17kp。Id. 因此,联邦巡回上诉法院得出结论,认为未落入FDA批准的规格标准的中间体溶解测试并不能满足Ferring对侵权的举证责任。Id. 综上所述,对专利法、科学和监管概念的深入了解和应用,使得Watson成功防御专利侵权,并顺利推出仿制药产品。
III 结 论
如上所示,经验丰富的律师可以制定有效的策略,以期在复杂的Hatch-Waxman法案下做到游刃有余。原研药企业往往获得有价值的市场独占,而这段独占期的长度则取决于它们是否获得了新的配方,发现了新的化学实体,或者获得了强大的发明专利。反过来,仿制药企业如果成功挑战原研药专利,则可以获得宝贵的180天仿制药独占期。虽然在美国专利纠纷可以是错综复杂的,但在FDA评估期间以及仿制药产品进入市场之前可以诉诸法律这一点,却着实能给各方带来益处。
此外,以上讨论的案例表明了在美国对ANDA规格标准进行透彻分析的重要性,以及在开发过程中考虑未决和已授权的专利权利要求的重要性——尤其是在最终策略是针对原研药企专利进行规避设计的情况下。在美国,异常并不一定就证明侵权。
(本文英文原文已于昨日在知产力国际微信订阅号发表:《An Overview Of ANDA Litigation In The United States》。您也可选择点击网页版链接查看:http://news.zhichanli.cn/article/5748.html)
注释:
1. 一般而言,NDA持有人不得列出有关该过程或生产活性药物成分的专利,但任何仿制药生产商仍应(尽可能)确定所有此类专利,作为与决定是否追求仿制药有关的尽职调查的一部分。理论上,没有列入“橙皮书”的专利可以不受Hatch-Waxman法案影响,只要仿制药已被FDA批准和在美上市,即可被用来对抗仿制药。
2. 申请人可以继续进行其ANDA申请而不对列出的专利提出质疑。第355(j)(2)(A)(vii)条款中规定的可利用证明包括:(I)该药品没有相关专利被列入橙皮书;(II)专利已经过期;(III)被列入橙皮书的专利到期前仿制药不上市;(IV)专利无效或者不会因生产、使用或销售药品而受到侵害。
3. 由于当时专利还没有获得授权,所以Watson进行ANDA申请时橙皮书没有列出专利。因此,FDA不会自动暂缓30个月批准。见35 U.S.C. § 355(j)(5)(B)。



















