前药和代谢物专利的授权、确权和侵权问题探讨
作者 | 李人久 熊玉兰 周艾琳 北京德和衡律师事务所
编辑 | viki
引 言
前药(prodrug)也称前体药物、药物前体、前驱药物等,是指药物经过化学结构修饰后得到的在体外无活性或活性较小、在体内经酶或非酶的转化释放出活性药物而发挥药效的化合物[1]。药物通常在体内代谢成代谢物,并且该代谢物往往是药物的活性成分。前药与代谢物是“鸡与鸡蛋”的关系,即前者可在人体内通过化学反应产生后者,两者结构不同[2]。前药与代谢物专利的授权、确权和侵权判断标准在各国专利审查和司法实践中不尽相同,这种不同导致在不同国家进行的专利稳定性评估和侵权风险预判较为复杂,甚至有点困难。本文主要结合多国案例,对前药、代谢物专利的授权、确权和侵权判断标准进行思考与总结,并基于我国《专利法》、《专利法实施细则》以及司法实践,就如何在华更好地保护前药、代谢物专利这一问题提出建议。
一、中、欧、韩、美关于前药专利授权、确权的审查实践
从上述国家和地区的专利审查实践来看,前药专利可能在保护范围清楚、说明书公开充分、权利要求得到说明书的支持以及新颖性和创造性方面被审查员提出反对意见。
1.关于权利要求的保护范围清楚
在中国专利审查实践中,如果权利要求使用了措辞“前药”而没有限定具体的结构,通常会被认为保护范围不清楚。例如在中国专利申请02821249.5复审案[3]中,实审通知书和复审通知书中认为:说明书对前药的解释仅限定在体内代谢形成试验上可检测量的美拉加群的任何物质,而某一物质能否在体内代谢成可检测的美拉加群不能简单地确定,而且上述解释没有限定检测方法、检测样品、检测时间,本领域技术人员根据其掌握的普通技术知识和本申请说明书中关于“前体药物”的解释均无法知晓究竟哪种(类型)的前体药物能够经由体内代谢转化成具有有效活性的所述代谢物,从而导致权利要求的保护范围不清楚。
与此类似地,欧洲申诉委员会在T1719/08案[4]复审通知书中认为: 本发明权利要求使用的术语“前药”属于功能性特征,申请人不仅试图涵盖本领域技术人员目前可以合理预期作为前药的化合物,还试图涵盖本领域技术人员基于本领域普通技术知识不能获得且尚未探索的可能化合物。为了确定除了说明书中描述的具体化合物之外的前药所包括的结构范围,本领域技术人员只能通过合成可能的候选化合物并测试其体内活性、毒性和代谢特性,这相当于邀请执行研究计划,需要付出过度劳动,特别是需要考虑受试者的可能多样性、前药候选化合物的可能多样性以及转化位点和机理的可能多样性。因此权利要求的保护范围不清楚。申请人在答复复审通知书时修改了权利要求,对前药的取代基团进行了限定,EPO申诉委员会认为申请人的修改克服了保护范围不清楚的缺陷。
在韩国达格列净(Forxiga®)专利的实质审查中,韩国知识产权局的审查意见中认为:权利要求使用了术语“前药酯”导致保护范围不清楚。申请人删除该术语后获得授权[5]。
美国专利局审查员课件中也认为,权利要求使用术语“前药”会导致保护范围不清楚[6]。
2. 说明书的充分公开和权利要求的支持
根据中国专利审查实践,权利要求请求保护“前药”的技术方案时,如果说明书未给出前药的药理活性试验结果,审查员可能会认为“所保护的前药”得不到说明书的支持[7]。在中国专利申请201380050982.9的实质审查程序中,权利要求18要求保护式III化合物或其前药,审查意见通知书中认为:由于说明书未对前药类型作出合理说明,因此“前药”限定了大量不同结构和种类的化合物,由于药物在体内的吸收和代谢过程非常复杂,某种“前药”是否能够以及何时转化为母体药物是本领域技术人员难以预期的,且说明书仅仅给出了式III化合物的一个具体前药化合物,因此权利要求18要求保护的式III化合物的前药得不到说明书的支持[8]。
在欧洲T1719/08案中,欧洲专利局申诉委员会在复审通知书中认为:申请人在权利要求中以功能性特征“前药”而非结构特征对化合物进行限定,说明书针对该功能性特征仅仅提供了有限的结构指引,没有提供关于本发明功能特征“前药”是否实现的评估方式,本领域技术人员不付出过度劳动不能设计出术语“前药”所包含的整个范围内的化合物,因此说明书公开不充分。
3. 新颖性和创造性
如果前药的化学结构未被现有技术公开,则保护该前药的专利保护的是新化合物,符合新颖性的规定。但由于前药化合物与代谢物结构相似,有可能存在创造性问题。
中国《专利审查指南》规定,判断化合物发明的创造性,需要确定要求保护的化合物与最接近现有技术化合物之间的结构差异,并基于进行这种结构改造所获得的用途和/或效果确定发明实际解决的技术问题,在此基础上,判断现有技术整体上是否给出了通过这种结构改造以解决所述技术问题的技术启示[9]。
欧洲专利局的审查实践中,为了满足创造性要求,申请人需要证明前药的设计对本领域技术人员是非显而易见的,最好是证明前药具有预料不到的技术效果[10]。
与欧洲类似,在美国,如果前药化合物与现有技术公开的活性代谢物结构非常类似,最好是通过预料不到的技术效果证明发明的创造性。在美国Lupin Limited v. Vertex Pharmaceuticals Inc. (IPR2016-00558)案[11]中,现有技术公开了抗HIV病毒的活性化合物安普那韦,涉案专利公开了该化合物的磷酸盐——前药福沙那韦,两者的结构如下:
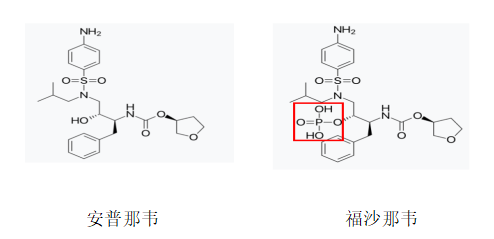
美国专利审判和上诉委员会(PTAB)认为:首先,福沙那韦显示了相对于安普那韦改进的作用模式,这是不能预期的,因为福沙那韦是作为递送安普那韦的前药;其次,福沙那韦还显示出预料不到的更好药代动力学特性。因此发明具有创造性。
二、中、美、欧关于代谢物专利授权、确权的审查实践
在保护范围清楚、支持和公开充分问题上,代谢物专利与前药专利具有类似性,如果权利要求使用了术语“代谢物”而不用结构特征进行限定,则可能存在保护范围不清楚的问题。如果没有试验数据证实代谢物的活性效果,则可能存在说明书公开不充分或者权利要求得不到说明书的支持等问题。
代谢物专利授权、确权中的一个重要方面是新颖性问题,即,如果代谢物的原始药物是已知的,并且原始药物在体内必然生成代谢物,则活性代谢物是否具有新颖性?对此,各国的审查实践并不相同。
针对此类情况,美国可能会因隐含公开认定活性代谢物专利缺乏新颖性。在Schering Corp. V. Geneva Pharmaceuticals, Inc.案[12]中,涉案专利请求保护去羧乙氧基氯雷他定(简称“DCL”),该物质是已知药物氯雷他定的活性代谢物。审理法院认为,涉案专利所包含的DCL既包括 “通过新陈代谢产生的DCL”,又包括 “体外合成的DCL”, 联邦巡回上诉法院(CAFC)指出,虽然现有技术没有明确披露DCL,但遵循现有技术中描述的方法给药氯雷他定时,体内必然产生代谢物DCL,最终CAFC援引在先案例,根据“实质隐含理论”,认定涉案专利化合物权利要求不具有新颖性。但法官在判决书中同时指出:如果权利要求请求保护纯化的活性代谢物、分离的活性代谢物、合成的活性代谢物、含有活性代谢物的药物组合物以及使用所述活性代谢物或药物组合物治疗疾病的方法发明,则现有技术不能破坏这类发明的新颖性。
与之不同的是,欧洲专利局并不认可“实质隐含理论”。如果现有技术公开了活性代谢物的前药化合物,虽然前药化合物吸收至体内后会发生降解,如果该现有技术没有公开活性代谢物结构,也没有教导如何分离或制备所述活性代谢物,欧洲专利局会认为该现有技术不能破坏活性代谢物专利的新颖性[13]。
中国的专利审查实践与欧洲类似,即使现有技术公开的前药化合物在体内代谢必然产生活性代谢物,如果发明保护的活性代谢物是一种结构从未被本领域技术人员认识、从未以纯的状态得到过的物质,应当认为具有新颖性[14]。
三、代谢物专利和前药专利的侵权判定实践
1. 代谢物专利的侵权判定
本节要讨论的问题是:如果一项专利请求保护活性代谢物,他人实施该活性代谢物的前药是否存在专利侵权风险?
从下列各国案例可以看出,他人实施活性代谢物的前药,存在对代谢物专利的等同侵权风险,但法院可能对权利要求限定的化合物作缩小解释,从而排除将前药纳入代谢物专利的保护范围,导致侵权不成立。所述缩小解释的例子如将“代谢物化合物”解释成“合成的代谢物化合物”和“体外制备的代谢物”。如果药物组合物发明或者医药用途发明使用“有效量”进行了限定,当专利权人不能证明“前药”产生了“有效量”时,实施代谢物的技术方案也可能可以规避侵权风险。
1.1 代谢物专利侵权成立的案例
在英国Beecham v. Bristol案[15]中,审理法院认定Bristol公司销售前药海他西林(Hetacillin)实际上构成对Beecham公司氨苄西林(Ampicillin)专利中产品权利要求的侵权。该审理法院采用的是“精髓侵权”原则”。【注:按照英国当时的专利司法实践,专利侵权分为两种类型:字面侵权和精髓侵权(即textual infringement和infringement of the pith and marrow[16]】
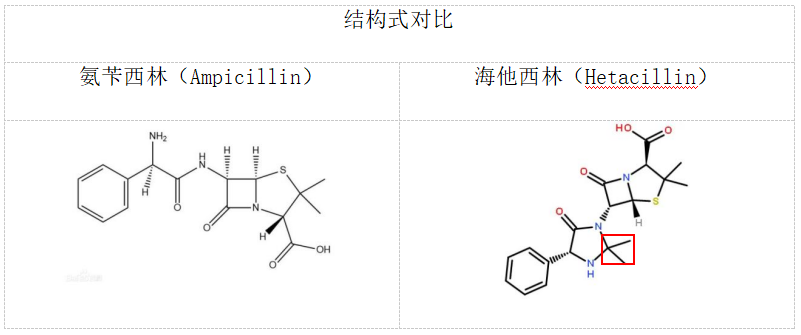
在日本曲尼司特案[17]中,日本名古屋高等法院认为:曲尼斯特盐酸盐与涉案专利保护的活性成分曲尼斯特游离碱达到同样的技术效果,进而认定两者等同。
在韩国达格列净(Forxiga®)专利侵案(Dong-A ST v. AstraZeneca)[18]中,涉案专利(专利权人AstraZenca)请求保护化合物达格列静。韩国Dong-A ST公司开发的药物为甲酸达格列静(达格列静的甲酸酯),甲酸达格列静被患者服用后在体内变为达格列静,因此在患者体内实际产生药理活性的物质为达格列静化合物。涉案专利在实质审查程序中,为了克服审查员指出的保护范围不清楚的问题,将权利要求的“达格列静及其前药酯”修改成“达格列静”后获得授权。韩国专利法院认为:专利权人在授权前的修改目的是为了克服审查员指出的形式缺陷,并不表明其意图放弃“前药酯”的方案,Dong-A ST公司开发的甲酸达格列静与涉案专利保护的达格列静结构相近,通过甲酸酯形式制备前药属于本领域的常规手段,并且甲酸达格列静相对于达格列静也没有产生任何显著的药理学效果,根据等同原则,Dong-A ST开发的甲酸达格列静落入涉案专利的保护范围。
在美国Ortho Pharmaceutical Corp. v. Smith,1990 WL 121353 (E.D.Pa. 1990)案中,涉案专利要求保护化合物炔诺孕酮和化合物醋酸炔诺孕酮,被告制备和销售的化合物为诺孕酯,审理法院认为:因为诺孕酯在体内降解为涉案专利保护的化合物炔诺孕酮和醋酸炔诺孕酮,诺孕酯的生物学活性主要来源于这两个降解产物,因此被告构成等同侵权[19]。
1.2 代谢物专利侵权不成立的案例
在美国Marion Merrell Dow Inc. v. Baker Norton Pharmaceuticals, Inc., 948 F. Supp. 1050(S.D.Fla.1996)案[20]中,涉案专利要求保护特非那定的代谢物TAM。被告制备和销售的产品为特非那定化合物,而特非那定化合物在体内转化为 TAM。原告认为被告制备和销售的特非那定被患者服用后转化为涉案专利请求保护的TAM,因此被告构成间接侵权。审理法院认为:根据说明书的记载和审查历史,涉案专利所保护的TAM应该解释成化学合成获得的TAM,其保护范围并不能包括由人体代谢产生的TAM,因此被告不构成侵权。
在美国Novartis Pharmaceutical Corp. v. Eon Labs Manufacturing, Inc., 363 F.3d 1306 (Fed. Cir. 2004)案[21]中,涉案专利保护含有环孢菌素固体颗粒的水溶胶。被告销售的环孢菌素胶囊被患者服用后在胃中变成涉案专利保护的水溶胶。审理法院结合说明书和审查历史认为:涉案专利权利要求所使用的术语“水溶胶”应该限于在体外制备的由固体颗粒的液体胶体溶液分散体组成的药物制剂,因此其保护范围不能延及体内形成的产物,被告的行为不构成字面侵权;同时,等同侵权要求所保护的特征与被控产品的特征之间的区别属于非实质性的,将涉案专利的保护范围扩大至包括胃内形成的分散体必然会超出权利要求中“水溶胶”的限定,因此也不构成等同侵权。在不存在直接侵权的情况下,自然也就不存在间接侵权。
在美国American Home Products Corp. v. Johnson & Johnson案[22]中,涉案专利涉及一种通过服用孕激素有效量(effective amount)的醋酸炔诺孕酮来预防女性受孕的方法。涉案药物诺孕酯在体内转化为涉案专利保护的醋酸炔诺孕酮,并最终转化为炔诺孕酮发挥药理活性。审理法院认为:由于炔诺孕酮预防女性受孕的方法已经进入公有领域,虽然被告销售的诺孕酯在体内转化为醋酸炔诺孕酮,但只要这种转化没有达到“孕激素有效量”的要求,即不构成侵权。由于原告并没有证明被告满足孕激素“有效量”的限制,因此不构成等同原则下的侵权行为。
在美国In re BUSPIRONE PATENT LITIGATION案[23]中,涉案专利请求保护通过全身给药不产生毒性的抗焦虑有效剂量的BMY 28674用于改善焦虑的方法,其中BMY 28674为丁螺环酮化合物的6-羟基代谢物。审理法院认为:术语“全身给药不产生毒性的抗焦虑有效量的BMY 28674”是指将体外测量用量的BMY28674给药至体内,而不能将其保护范围扩大至体外给药所述剂量的前药丁螺环酮,因为给予前药丁螺环酮时,患者体内所产生的代谢物BMY28674的血药浓度是变化的,并非“不产生毒性的抗焦虑有效剂量”,因此认定实施前药丁螺环酮的技术方案不落入涉案专利的保护范围。
2. 前药专利的侵权判定
本节要讨论的问题是:如果一项专利请求保护前药化合物,他人实施的方案属于该前药化合物的活性代谢物,是否存在专利侵权风险?
目前为止国内外均没有与此相关的案例。从理论上分析,活性代谢物的结构不同于前药化合物的结构,显然不构成字面侵权,但在满足等同原则的情况下,有可能构成等同侵权。
四、前药、代谢物的专利保护策略探讨
本文介绍了多国对前药和代谢物专利的授权、确权和侵权实践标准,采取何种方式保护上述专利和相关企业如何规避侵权风险是备受关注的课题。由于前药、代谢物一般不是同时研发面世,如果其中一种已经存在于现有技术中,则保护后续开发的产品总是颇具挑战性。笔者在这里浅谈如何更好地保护前药、代谢物。
如果前药和代谢物均未被现有技术公开,申请人同时开发出前药和代谢物,可以考虑分步申请专利,在先申请尽量撰写大的保护范围以同时包括前药和代谢物,在后申请保护改进发明或选择发明。在后申请中要尽可能描述全面的技术效果,以便可通过预料不到的技术效果主张其相对于在先申请具有创造性。
如果现有技术已经公开了前药,申请人随后开发出代谢物化合物,为了避免在美国等国家面临隐含公开的新颖性问题,代谢物专利申请文件中应该包括能够规避隐含公开而确立新颖性的技术方案,例如:合成来源的化合物、体外制备的化合物、纯化合物、含有所述化合物和可药用载体的药物组合物、无定形化合物、晶体化合物、固体形式的化合物、给药化合物至患者体内治疗疾病的方法、化合物在医药组合物中的用途等[24]。如果现有技术已经公开了代谢物化合物,申请人随后开发出前药,由于结构不同,请求保护前药的专利申请不存在新颖性问题。关于创造性,如前文所述,在申请文件中要尽可能描述全面的技术效果,以便可通过预料不到的技术效果主张其相对于代谢物具有创造性。
另外,对于代谢物专利,说明书需要记载药效学数据,对于前药专利,说明书需要记载药物代谢数据或药效数据以证明前药确实能够实现医药用途,避免因医药用途不能实现而导致说明书公开不充分或者权利要求得不到说明书支持。
权利要求使用“前药”和“代谢物”等术语而不限定这些物质的具体结构时可能会使保护范围不清楚,因此在提交专利申请时要考虑明确特定类型的衍生物[25]。实践中通常允许盐、溶剂化物/水合物与活性化合物权利要求同时存在,但其他形式的衍生物不容易获得保护,例如酯等[26]。但从某些国家的实践看,仍然可以尝试在权利要求书中使用“前药”等术语以获取较大的保护范围,例如,说明书可以提供明确具体的测试方法以确定待选化合物是否属于前药的范围,以克服保护范围不清楚的缺陷[27]。
五、代谢物和前药专利侵权的抗辩探讨
尽管我国目前还没有前药转化为体内代谢化合物相关的专利侵权诉讼案例,根据上文中其他国家的经典案例不难看出,在涉及前药和代谢物的专利侵权诉讼中,除了常规的不侵权抗辩外,针对不同国家的专利制度和司法实践,可以采取不同的专利侵权抗辩方式,例如:
1. 对于在美国的代谢物专利侵权诉讼,如果现有技术公开了前药,可以主张现有技术公开的前药在患者体内必然产生代谢物,主张代谢物专利因现有技术的隐含公开而丧失新颖性。另外,根据美国最高院Molecular Pathology v. Myriad Genetics, Inc.案[28],还可以主张专利所保护的代谢物属于“自然产物”,从而不属于专利法第101条规定的授权主题。
2. 针对专利权利要求使用“某某化合物的前药”或“某某化合物的代谢物”等术语而没有限定前药或代谢物的具体结构时,可以主张权利要求的保护范围不清楚、得不到说明书的支持或者说明书公开不充分,以进行专利无效抗辩。
3.现有技术公开前药或代谢物的情况下,需要判断专利保护的化合物相对于现有技术是否显而易见,是否具有预料不到的技术效果,以确定是否能够以不具有创造性主张专利无效。
4.可以把代谢物专利保护的化合物解释成“体外合成的化合物”,前药虽然在体内产生了代谢化合物,但该代谢物不属于专利保护的“体外合成的化合物”,因此不落入专利保护范围。
5.代谢物专利权利要求如果使用了“有效量”等术语,可以主张没有证据表明施用前药满足权利要求关于“有效量”的限定,从而不落入专利保护范围。
诚如在文首提到的,不同国家的专利制度与司法实践各有特点、存在差异,相关企业不能以一种理解与策略应对不同目标国家。由于目前我国尚无涉及前药、代谢物的专利侵权纠纷的案例,因此本领域企业应持续关注我国立法动态与司法实践,以及时调整策略以更好地保护相关成果或避免侵权风险。
注释
[1]尤启东. 药物化学 [M].北京:化学工业出版社,2015第二版:31-33.
[2]Ralph Minderop,etc., Prodrugs and metabolites-in the twilight zone of patentability, IP in the Life Science Industries 2013, pp9-12.
[3]国家知识产权局针对中国专利申请02821249.5的复审决定(决定日:2008.11.11)
[4]欧洲申诉委员会案例T1719/08(2011.2)
[5]Korean Patent Court Confirms for the First Time that a Pharmaceutical Compound Patent Covers Generic Prodrugs, https://www.lexology.com/library/detail.aspx?g=0b7f86d8-1cc4-45a8-8adf-87d44288f541, 最后访问日期2022年10月24日。
[6]Issue in Small Organic Molecules, https://www.aipla.org/docs/default-source/committee-documents/bcp-files/mhartley_isom.pdf?sfvrsn= 1946cd17_2,最后访问日期2022年10月24日。
[7]李捷,中国政法大学硕士论文《专利申请的支持性问题研究》(2009.10)
[8]中国专利申请201380050982.9第一次审查意见通知书(2016.2),来源:CNIPA中国及多国专利审查信息查询网
[9]中国《专利审查指南》(2021)第二部分第十章第6.1节
[10]Ralph Minderop,etc, Prodrugs and metabolites In the twilight zone of patentability? IP in the Life Sciences Industries 2013,www.iam-agazlne.com
[11]Lupin Limited v. Vertex Pharmaceuticals Inc. (IPR2016-00558), https://cdn2.hubspot.net/hubfs/454850/Lupin%20v.%20Vertex%20(IPR2016-00558).pdf
[12]Schering Corp. V. Geneva Pharmaceuticals, Inc. 339 F.3d 1373 (Fed. Cir. 2003).
[13]Ralph Minderop,etc,Prodrugs and metabolites in the twilight zone of patentability? IP in the Life Sciences Industries 2013,pp 9-12.
[14]张清奎,专利审查实践论,知识产权出版社2013年4月第1版,第224页。
[15]Beecham Group Limited v. Bristol Laboratories Limited. R.P.C., 153 (1978).
[16]Zondo, Raymond Mnyamezeli Mlungisi (2012) The replacement of the doctrine of pith and marrow by the catnic test in English Patent Law: a historical evaluation, University of South Africa, Pretoria. https://uir.unisa.ac.za/handle/10500/5697
[17]Takeshi Komatani. Scope of protection of a patent directed to prodrugs, metabolites and the like [J]. Pham. Pat Anal, 2014, 3(6): 568.
[18]https://www.lexology.com/library/detail.aspx?g=0b7f86d8-1cc4-45a8-8adf-87d44288f541(2022.4)
[19]959 F.2d 936 (Fed. Cir. 1992)
[20]Marion Merrell Dow Inc. v. Baker Norton Pharmaceuticals, Inc., 948 F. Supp. 1050 (S.D. Fla. 1996)
[21]Novartis Pharmaceutical Corp. v. Eon Labs Manufacturing, Inc., 363 F.3d 1306 (Fed. Cir. 2004)
[22]American Home Products Corp. v. Johnson & Johnson. 979 F.2d 216 (Fed.Cir.1992)
[23]185 F. Supp. 2d 340 (2002)
[24]Ralph Minderop, Arwed Burrichter and Natalie Kirchhofer. Prodrugs and metabolites-in the twilight zone of patentability [J]. IP in the Life Sciences Industries 2013: 9-12.
[25]Ralph Minderop, Arwed Burrichter and Natalie Kirchhofer. Prodrugs and metabolites-in the twilight zone of patentability [J]. IP in the Life Sciences Industries 2013: 9-12.
[26]Takeshi Komatani. Scope of protection of a patent directed to prodrugs, metabolites and the like [J]. Pham. Pat Anal, 2014, 3(6): 569.
[27]Ralph Minderop, Arwed Burrichter and Natalie Kirchhofer. Prodrugs and metabolites-in the twilight zone of patentability [J]. IP in the Life Sciences Industries 2013: 9-12.
[28]Association for Molecular Pathology v. Myriad Genetics, Inc. (133 S. Ct. 2107) (2013)
(本文仅代表作者观点,不代表知产力立场)



















