帕妥珠单抗、达格列净 、利拉鲁肽等药品遭遇专利挑战
专利链接制度落地后,随着原研药企专利公示的逐渐增多,中国仿制药企业锚定仿药及市场布局并进入上市申请程序后,作出首仿决定并提交4.1类(药品专利挑战)声明的数量也进一步增长。基于知产宝对口审公告数据的数据分析,仿制药企业针对必须避让的原研专利提出无效宣告申请的进程也进一步加快。
以下为截至发稿前,本月专利复审委已公布的涉药品专利口审公告信息。
*信息来源:知产宝药品专利链接数据库、知产宝专利数据库、国家药监局、FDA、Google Patent 等公开检索渠道。
作者 | IvesDuran 赫密斯
编辑 | 墨客
01
健泰康生物 vs 齐鲁制药
抗乳腺癌 帕妥珠单抗

口审信息概览
专利申请号:201210006776.5
复审专利名称:HER抗体的固定剂量给药
专利权人:健康泰科生物技术有限公司
(基因泰克公司,Genentech Inc;2010年,罗氏全资收购基因泰克)
无效请求人:齐鲁制药有限公司
口审日期:7月1日
与此同时,齐鲁制药还针对ZL200980111007.8“包含结合HER2结构域II的抗体及其酸性变体的组合物”提起无效宣告请求,公开可查的口审日期定在6月1日、30日,该专利的保护期限将于2029年1月28日截止。

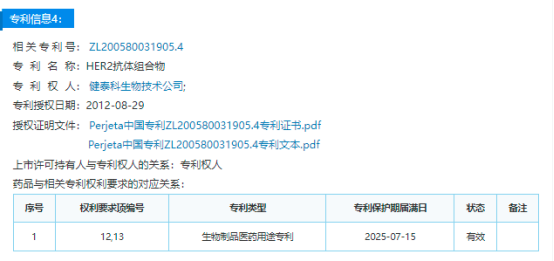
专利信息概览
本专利描述了一种治疗癌症的方法,涉及HER抗体,如Pertumzab的固定剂量给药。
申请日:2005年6月15日
公开日:2012年7月18日
授权公告日:2016年11月23日
专利保护期届满日:2025年6月15日

涉案药品信息

药品名:帕妥珠单抗 (Pertumzab)
商品名:帕捷特 (Perjeta)
适应症:转移性乳腺癌、早期乳腺癌
2012年6月8日,帕妥珠单抗获得美国FDA批准上市。2018年12月17日,国家药监局批准上市。
公开资料显示,帕妥珠单抗的欧盟专利将于2023年到期、美国专利将于2024年到期。国内外已有多家企业布局该款药物的生物类似药(Biosimilar)研发。在国内,恒瑞医药、石药集团、正大天晴、齐鲁制药已开展本产品的临床试验。

中国药品专利公示信息


02
阿斯利康 vs 鲁抗医药
2型糖尿病 达格列净

口审信息概览
专利申请号:201210054766.9
专利名称:C-芳基葡糖苷SGLT2抑制剂和方法
专利权人:阿斯利康(瑞典)有限公司
请求人:山东鲁抗医药股份有限公司
口审日期:7月1日

专利信息概览
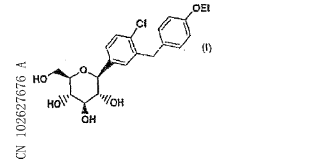
本发明提供了抑制SGLT2的化合物,其具有式(1)的化学结构。本发明还提供了单独应用SGLT2抑制量的上述化合物或联合应用SGLT2抑制量的上述化合物和其它抗糖尿病试剂或其它治疗试剂来治疗糖尿病和相关疾病的方法。
申请日:2003年5月15日
授权公告日:2012年10月3日
2014年7月2日,该件专利权由百时美施贵宝公司转让至阿斯利康(瑞典)有限公司名下。

涉案药品信息

药品名:达格列净 (Dapagliflozin)
商品名:安达唐 (Forxiga)
适应症:2型糖尿病
2012年,达格列净获欧洲EMA首次批准,是全球第一个获批上市用于治疗2型糖尿病的SGLT2抑制剂。
2017年,达格列净获批进入中国。目前,国内已有20余家企业布局达格列净仿制药市场,其中,山东鲁抗医药和北京福元医药率先过评,并于2021年10月同时拿下国内首仿。
另,南京正大天晴、成都倍特等9家企业递交了上市申请,上海信谊联合医药、南京方生和医药、石药欧意、宁波美诺华天康药业等企业处于BE试验阶段,还有多家获批临床。
03
晶云药物 vs“稻草人”
涉抗心衰药物专利“狙击”

口审信息概览
专利申请号:201610154363.X
专利名称:AHU377的晶型及其制备方法与用途
专利权人:苏州晶云药物科技股份有限公司
复审请求人:张璋
口审日期:2022年7月5日

专利信息概览
专利申请日:2016年3月18日
授权公告日:2018年5月8日
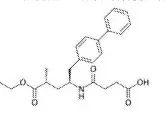
本发明涉及AHU377的晶型及其制备方法和用途。本发明提供的新晶型稳定性好,引湿性低,工艺提纯效果显著。本发明提供的式(Ⅰ)化合物(AHU377)的新晶型可用于制备抗心衰药物的用途。
经检索显示,国内尚未有药品公示涉及该专利,也未见仿制药声明包含该专利。该专利无效申请看似与原研与仿制企业的攻防无关。但值得注意的是,在此之前同一个无效宣告申请人曾针对苏州晶云名下另一件抗心衰药物专利——201580002782.5“一种包含缬沙坦和AHU377的三钠盐超分子复合物的新晶型及其制备方法”专利提起无效宣告请求。
该案的口审公告日期为2021年11月5日,无效审查决定日为2021年12月30日,审查结果——维持发明专利权有效。
决定要点:请求人主张权利要求概括的方案中存在不能解决发明技术问题的具体方案,然而其所述的具体方案与权利要求特征不同,并未涵盖在权利要求的保护范围内,请求人也未提供其它足以证明权利要求得不到说明书支持的证据,因此请求人所述权利要求没有以说明书为依据的无效理由不能成立。

扫描上方二维码
获取口审决定书全文

关联信息:诺华 vs 晶云美国专利诉讼
无独有偶,2019年10月,诺华曾在美国特拉华州联邦初级法院向包括苏州晶云美国全资子公司——科睿思(Crystal Pharmatech)在内的15位报告提起诉讼,主张在其拥有的US8,101,659、US8,796,331、US8,877,938及US9,388,134四项美国专利到期之前,包含科睿思在内的15位被告提交的关于沙库巴曲缬沙坦钠片(同样是抗心衰药物)的首仿药申请,寻求商业生产、使用、销售、许诺销售或进口沙库巴曲缬沙坦钠片的行为,均构成对诺华的专利侵权。目前这起美国诉讼尚未了结。
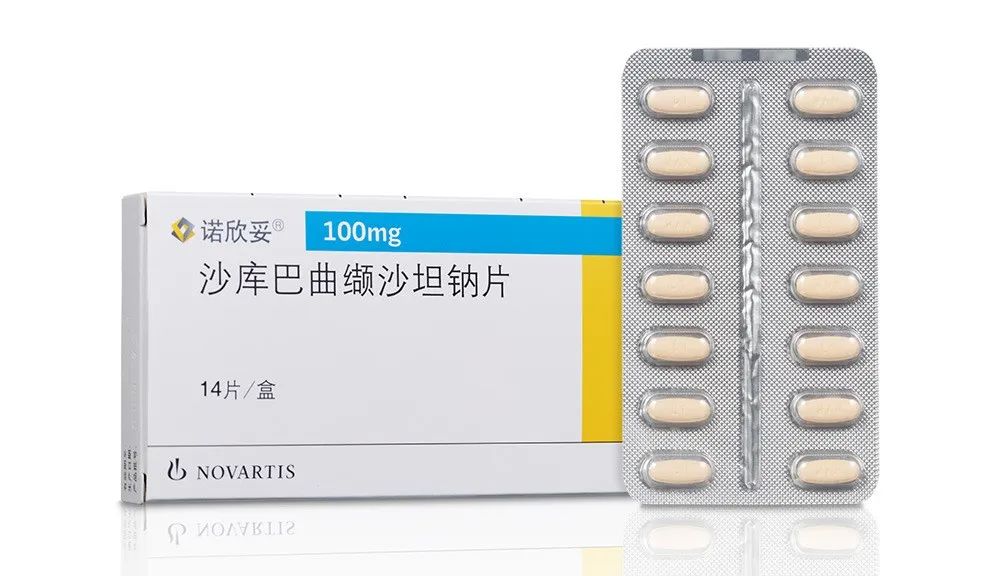
诺欣妥(Entresto)(药品名:沙库巴曲缬沙坦钠片)是诺华推出的一款抗心衰药物,是血管紧张素II抑制剂缬沙坦(Valsartan)和脑啡肽酶抑制剂沙库必曲(Sacubitril,又称AHU-377)的复方组合,能够有效降低慢性心衰病人心脏病死亡和因心衰住院风险。
2015年7月7日,美国FDA首次批准诺欣妥上市。2019年7月8日,科睿思向美国FDA提交了针对诺欣妥的首仿申请,同时提交了ParagraghIV声明,主张沙库巴曲缬沙坦钠片的相关原研专利是无效的,或者其制造、使用或销售所提交申请的药品不会侵犯相关原研专利。

另,2021年12月,诺华针对科睿思提起专利侵权诉讼,涉案专利为US11,135,192。目前该案仍在审理之中,不免令人疑惑是否与现在国内发生的几起针对苏州晶云的专利无效宣告申请有所联系。
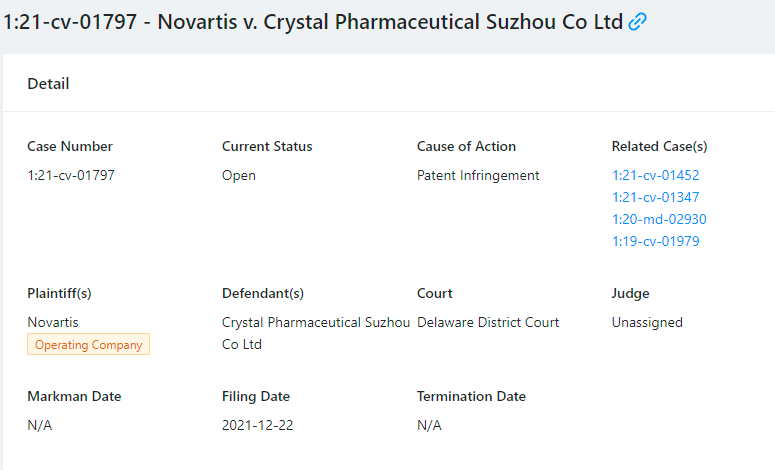

扫描上方二维码
获取1:21-cv-01797 诉讼文书
相关专利诉讼案件进展,知产力MED+将持续关注。
04
第一三共株式会社 vs 扬子江药业
抗凝血药物 甲苯磺酸艾多沙班片

口审信息概览
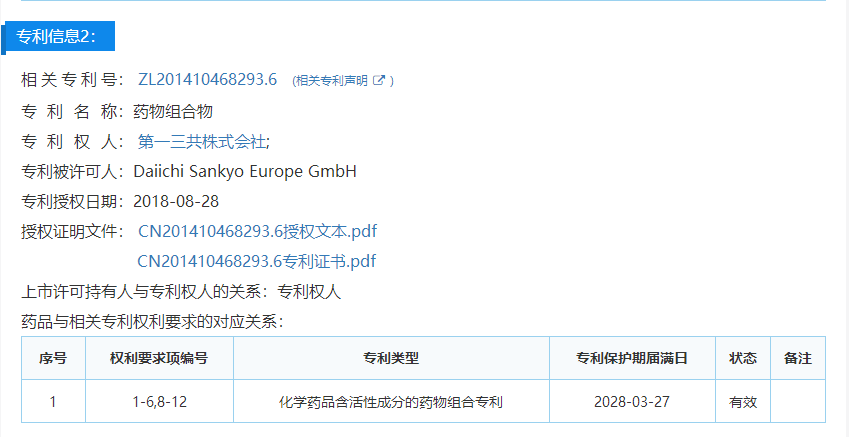
专利申请号:201410468293.6
专利名称:药物组合物
专利权人:第一三共株式会社(Daiichi Sankyo Europe GmbH)
复审请求人:扬子江药业集团南京海陵药业有限公司
口审日期:7月14日

专利信息概览
专利申请日:2008年3月28日
授权公告日:2018年8月28日
专利类型:药物组合物专利
专利保护期届满日:2028年3月27日
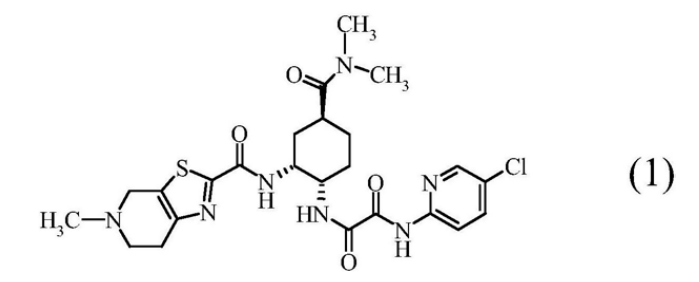
本发明提供在宽的pH范围内显示良好的溶出性的制剂。所述药物组合物含有:( A )下述式( 1 )表示的N1-( 5-氯吡啶-2-基 )-N2-(( 1S,2R,4S)-4-[(二甲基氨基)羰基]-2-{[(5-甲基-4,5,6,7-四氢噻唑并[5,4-c]吡啶-2-基)羰基]氨基}环己基)乙二酰胺、其药理上可接受的盐、或它们的水合物;和( B )选自糖醇类和水溶胀性添加剂中的1种或2种以上。

涉案药品信息
关联药物是第一三共株式会社推出的一款甲苯磺酸艾多沙班片(里先安)。

药品名:甲苯磺酸艾多沙班片
商品名:里先安 (Lixianan)
功效:预防卒中和体循环栓塞、治疗成人深静脉血栓(DVT)和肺栓塞(PE)等
2021年6月4日,第一三共株式会社在中国首次提交药品专利公示。

关联信息:扬子江药业 VS 第一三共 首仿挑战
甲苯磺酸艾多沙班片(里先安)这款沙班药物曾是抗血栓药300亿元市场中的“明星”之一,也是扬子江药业在抗血栓药物市场对沙班片的一大潜力布局。
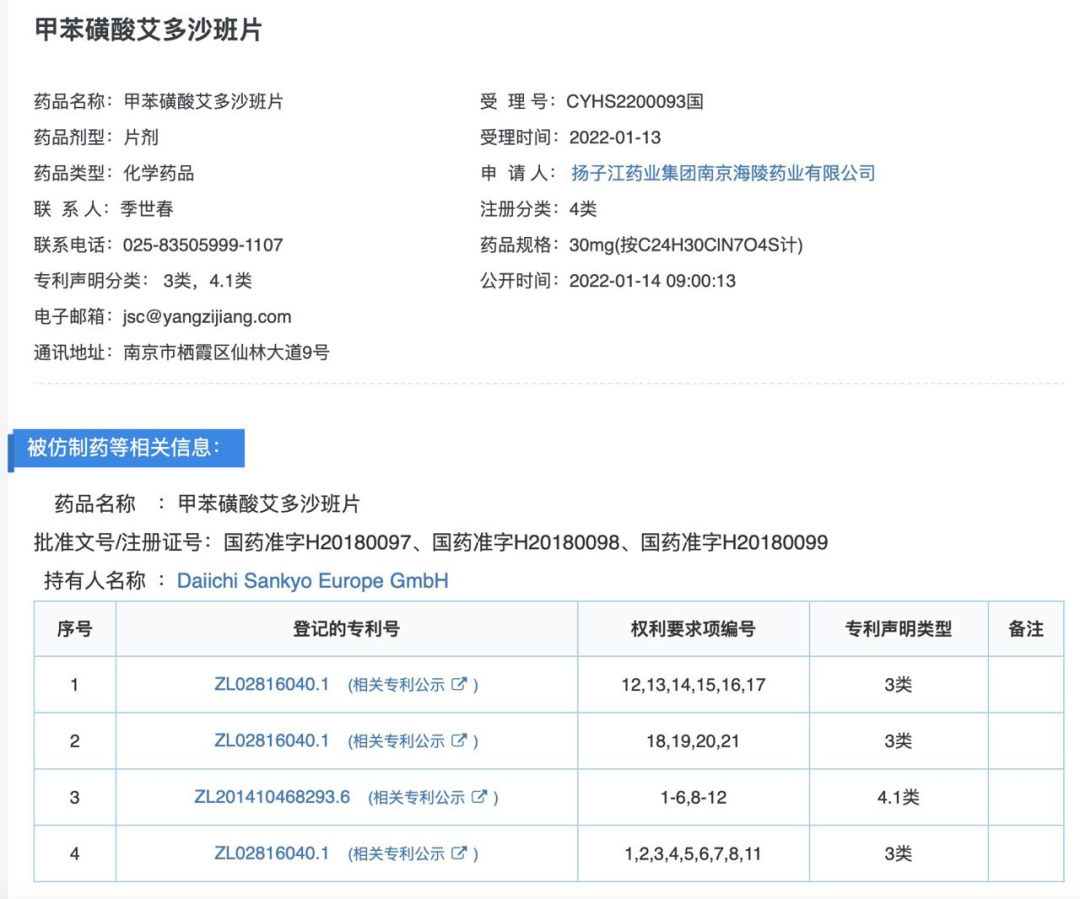
该药物在知产宝药品专利链接数据库中已显示被扬子江药业集团提出了4.1类仿制药专利声明(即专利无效声明)。
对于扬子江药业来说,此专利无效将进一步为其赢得在沙班类抗血栓药的优势。据了解,扬子江药业在2020年拿下利伐沙班片的生产批文,2021年阿哌沙班片获批,均按新分类获批视同过评。待甲苯磺酸艾多沙班片获批上市后,基于上述三大药品布局,扬子江药业将在抗血栓药物市场获得更大竞争力。
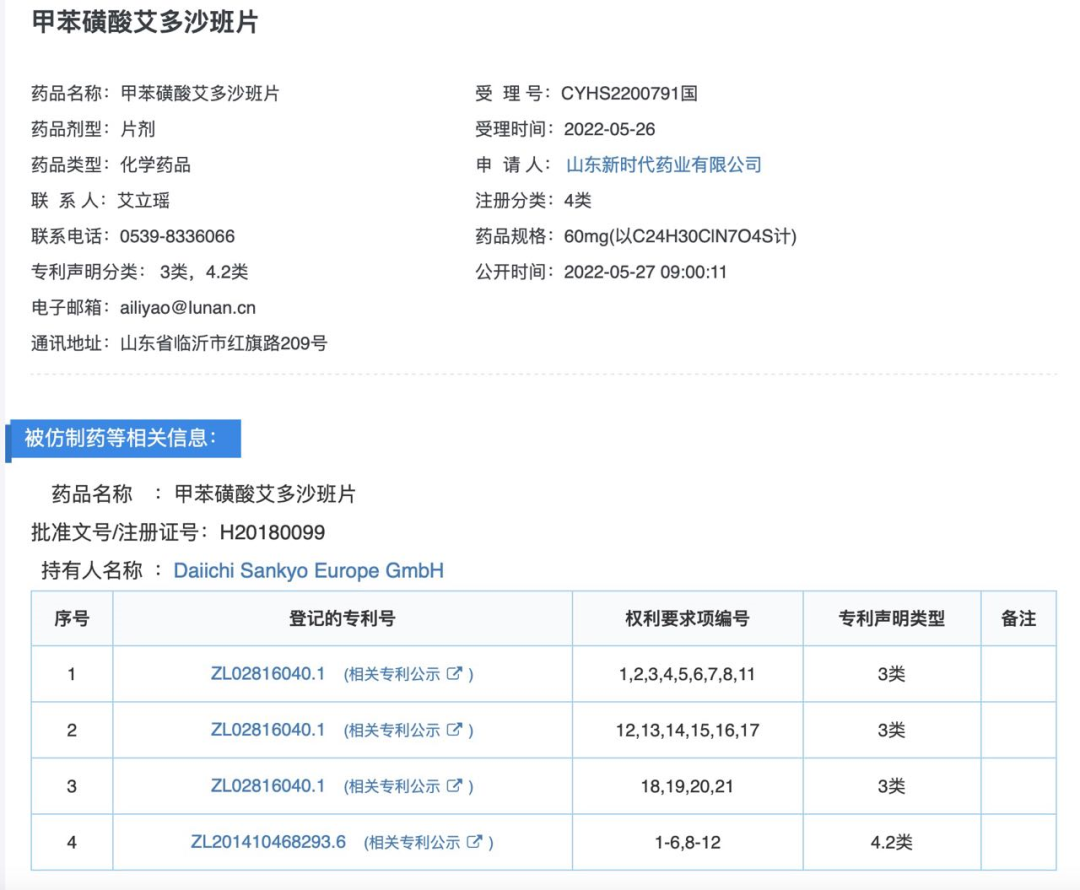
值得一提的是,除了扬子江药业以外,山东新时代药业有限公司在今年5月份也进行了专利声明,但就该专利采用的是4.2类声明,可见此次专利挑战也是扬子江药业能否占得先机的关键之战。
05
中外制药株式会社 vs 丽珠单抗
类风湿性关节炎 托珠单抗

口审信息概览
专利申请号:200480011401.1
专利名:治疗白介素-6相关疾病的方法
专利权人:中外制药株式会社(下称中外制药,Chugai Pharmaceutical Co.)
复审请求人:珠海市丽珠单抗生物技术有限公司(下称丽珠单抗公司)
百奥泰生物制药股份有限公司(下称百奥泰生物制药)
口审日期:7月25日

专利信息概览
本发明涉及治疗白介素‑6(IL‑6)相关疾病的药物组合物,包括白介素‑6拮抗剂(IL‑6拮抗剂)和免疫抑制剂。IL‑6拮抗剂优选抗白介素‑6受体(IL‑6R)的抗体。本发明的药物组合物可以口服或胃肠外以及全身或局部给药。
国际申请号:PCT/ JP2004/006211
申请日:2004年4月28日
公开日:2006年10月18日
授权公告日:2011年6月15日

涉案药品信息
药品名:托珠单抗(Tocilizumab)
商品名:雅美罗(EMA商品名:RoActemra,FDA商品名:Actemra)
托珠单抗由罗氏制药与其控股公司中外制药株式会社联合研发,是重组人源化抗人IL-6R单克隆抗体注射液。
2008年4月、2009年1月和2010年1月,托珠单抗先后在日本、欧洲和美国获准用于治疗类风湿性关节炎。
2013年,托珠单抗在国内首次获批,适应症为类风湿性关节炎。目前,该药在国内获批的适应症还包括全身型幼年特发性关节炎、成年和2岁及以上儿童患者由CAR-T细胞引起的重度或危及生命的细胞因子释放综合征等。
2021年11月8日,百奥泰生物制药提交的托珠单抗类似药上市申请获受理,申报的适应症包括类风湿关节炎、全身型幼年特发性关节炎、细胞因子释放综合征。
同年12月22日,国家药监局受理了丽珠制药针对托珠单抗类似药提交的上市申请。

中国药品专利公示信息

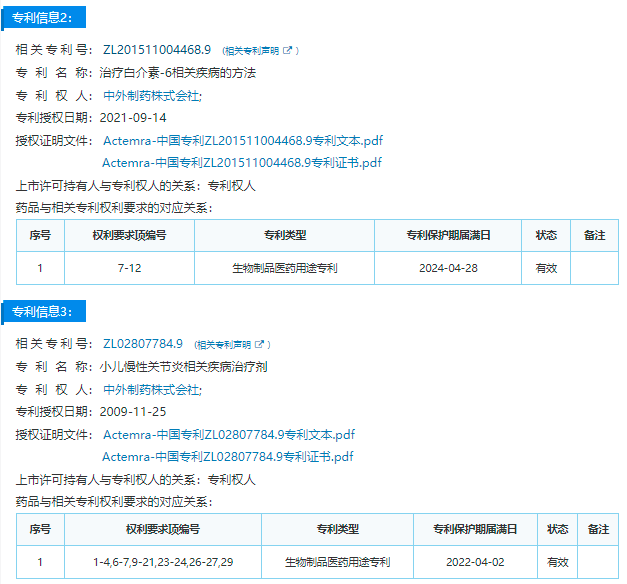

托珠单抗相关专利挑战信息
国内方面,已涉及一项相关专利无效宣告案。
专利申请号:200880119066.5
专利名称:含高浓度抗体的溶液制剂
专利权人:中外制药株式会社、弗·哈夫曼·拉罗切有限公司
专利申请日:2008年12月26日
专利公开日:2017年5月10日
该专利共包含20项权利要求,描述了一种稳定的含抗白细胞介素-6受体抗体的溶液制剂,其特征在于含有精氨酸和甲硫氨酸,是长期保存时二聚体的生成及脱酰胺化被抑制的、稳定的、适于皮下施用的含抗体的制剂。
无效宣告请求人:文珺
专利复审决定日:2020年12月23日
请求人理由:
权利要求1和15缺少必要技术特征,不符合专利法实施细则第21条第1款的规定。权利要求1-17没有以说明书为依据,不符合专利法第26条第4款的规定。权利要求1-17不具备创造性,不符合专利法第22条第3款的规定。
审查阶段,专利权人对权利要求书所作的修改包括:
在原权利要求1、15中补入原权利要求3、5、7、8的技术特征“其还含有表面活性剂”“所述溶液制剂的pH为4~8”“表面活性剂的量是0.0001~10w/v%”“抗体是人源化的抗-IL-6受体抗体MRA”,从而缩小权利要求1的保护范围;
在原权利要求6中补入原权利要求11、12、13的技术特征“其中所述溶液制剂于22~28℃至少6个月稳定”“抗体二聚化被抑制”“抗体分子的脱酰胺化被抑制”形成新的权利要求4;
在原权利要求14中引入原权利要求10-13的技术特征“其粘度为2~15mPa·s”“其中所述溶液制剂于22~28℃至少6个月稳定”“抗体二聚化被抑制”“抗体分子的脱酰胺化被抑制”形成新的权利要求12;
删除原权利要求3、5以及权利要求6中关于“人抗体”的并列技术方案;
适应性调整修改后的权利要求编号以及引用关系。
决定结果:
在专利权人于2019年12月30日提交的修改后的权利要求1-15的基础上,维持200880119066.5号发明专利权有效。

扫描上方二维码,
获取该案复审文书
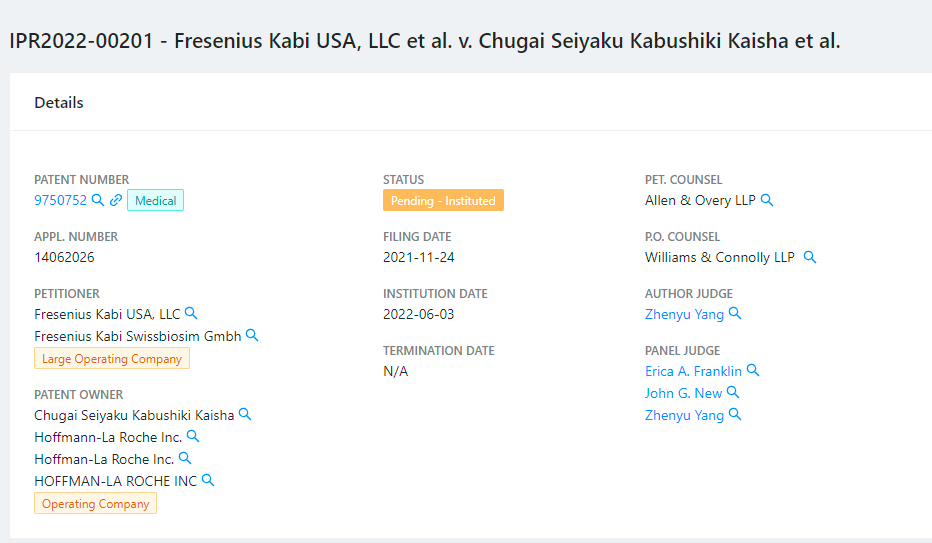
(source: Unifed Patent)
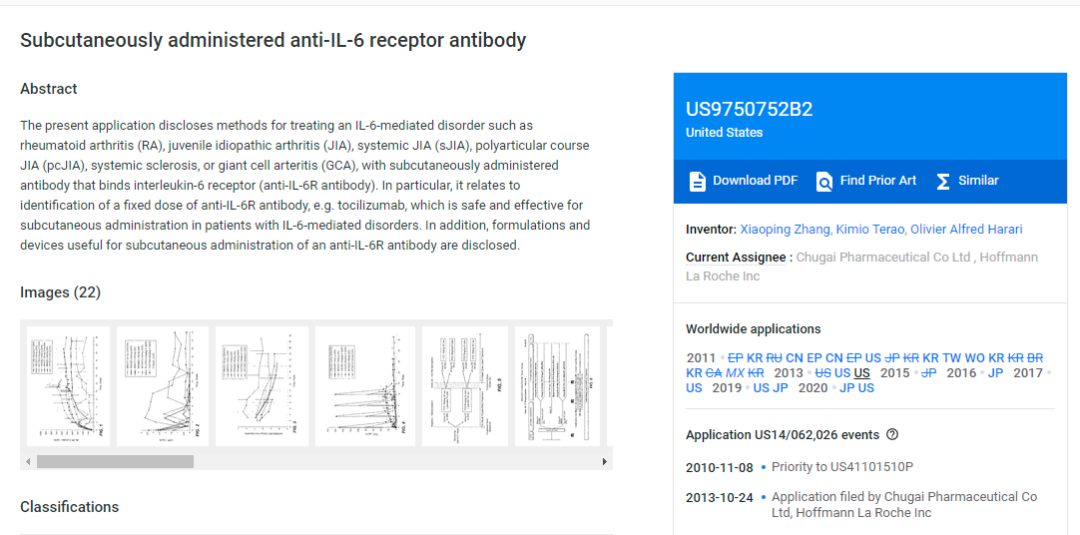
(US9,750,752专利)
国外方面,2022年6月3日,美国专利审查和上诉委员会(PTAB)对由中外制药株式会社和罗氏公司拥有的US9,750,752专利(下称752号专利)启动了双方复审程序。该专利涉及通过皮下注射托珠单抗治疗巨细胞动脉炎的方法。
752号专利的复审请求人为Frensenius Kabi(费森尤斯卡比公司,是基础药物、临床营养产品和医疗器械的供应商。旗下生产的药品包括紫杉醇、伊立替康、多西他赛等),其针对752专利的权利要求1-16提交了多方审查的请愿书。
PTAB只处理了费森尤斯卡比公司提出的两个显而易见的理由中的一个,并认为费森尤斯卡比公司已经证明了其获胜的合理可能性。

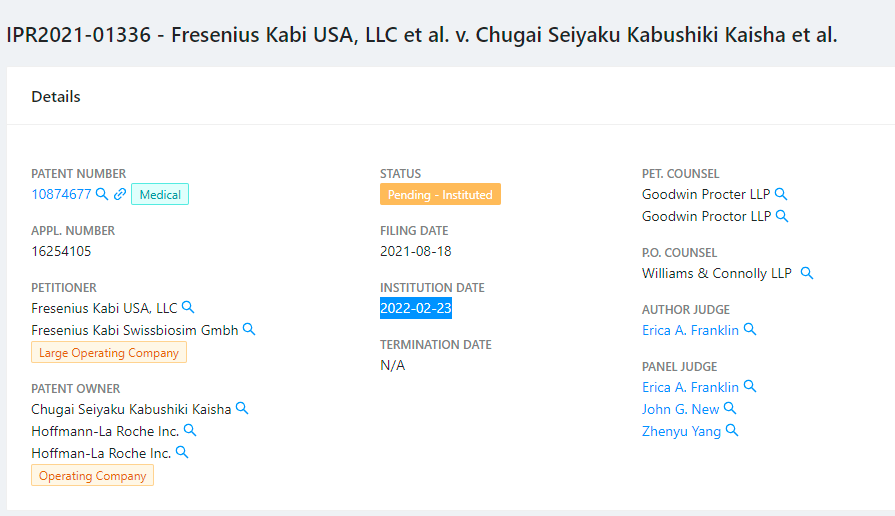
在此之前,今年上半年,PTAB还针对费森尤斯公司提出的复审请求,对中外制药株式会社、罗氏持有的US8,580,264、10,874,677专利的相关权利要求进行审查。这两件专利均涉及类风湿性关节炎的治疗方法,专利名称均为“皮下注射的抗IL-6受体抗体”(Subcutaneously administered anti-IL-6 receptor antibody)。
06
诺和诺德 vs 中美华东制药
2型糖尿病 德谷胰岛素

口审信息概览
专利申请号:200480021733.8
专利名:新型胰岛素衍生物
专利权人:诺和诺德公司(Novo Nordisk)
复审请求人:杭州中美华东制药有限公司(下称中美华东制药)
口审日期:7月26日

专利信息概览
本发明涉及在生理pH值下可溶并具有延长的作用特性的新型人胰岛素衍生物。本发明还涉及提供这类衍生物的方法、含有它们的药物组合物、使用本发明的胰岛素衍生物治疗糖尿病和高血糖的方法以及这类胰岛素衍生物在治疗糖尿病和高血糖中的应用。
申请日:2004年7月22日
公开日:2006年9月6日
授权公告日:2012年7月4日

涉案药物信息
药品名:德谷胰岛素
商品名:诺和益
适应症:2型糖尿病
2021年10月,国家药监局批准诺和诺德公司研发生产的德谷胰岛素利拉鲁肽注射液(诺和益),适用于血糖控制不佳的成人2型糖尿病患者,在饮食和运动基础上联合其他口服降糖药物,改善血糖控制。
德谷胰岛素是全球首个基础胰岛素胰高糖素样肽-1受体激动剂(GLP-1RA)注射液,是诺和诺德公司基于酵母表达系统及脂肪酸链修饰技术研发并生产销售的一种超长效基础胰岛素类似物。
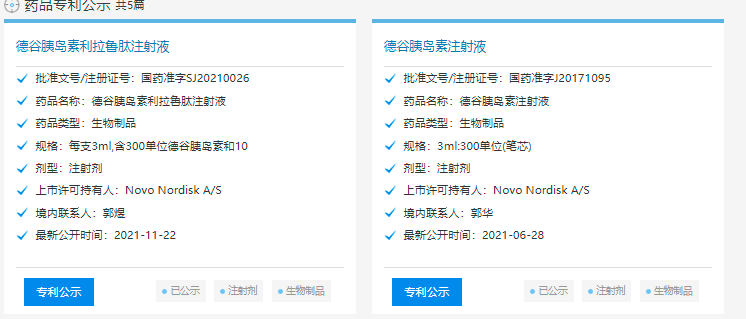
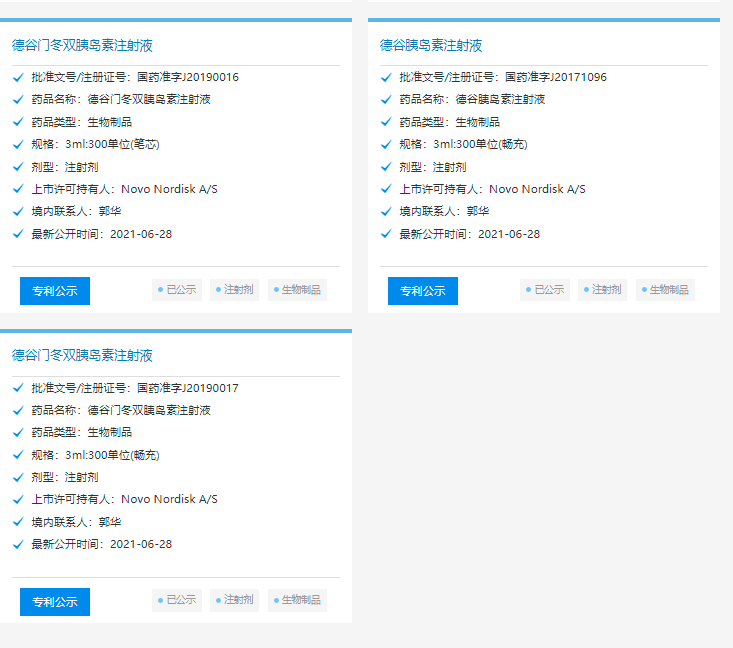
诺和诺德公司研发的不同剂型的德谷胰岛素、德谷门冬胰岛素在国内均已获批。德谷胰岛素是长效胰岛素,门冬胰岛素是速效胰岛素。德谷门冬双胰岛素,包含70%德谷胰岛素和30%门冬胰岛素,两种组分在制剂中独立存在,皮下注射后各自发挥作用。
2012年10月,德谷胰岛素首次在日本获批上市。同年11月,获得欧盟药品管理局批准上市。2015年9月,该药物获得美国FDA批准上市。2017年8月,利拉鲁肽在国内的专利到期。
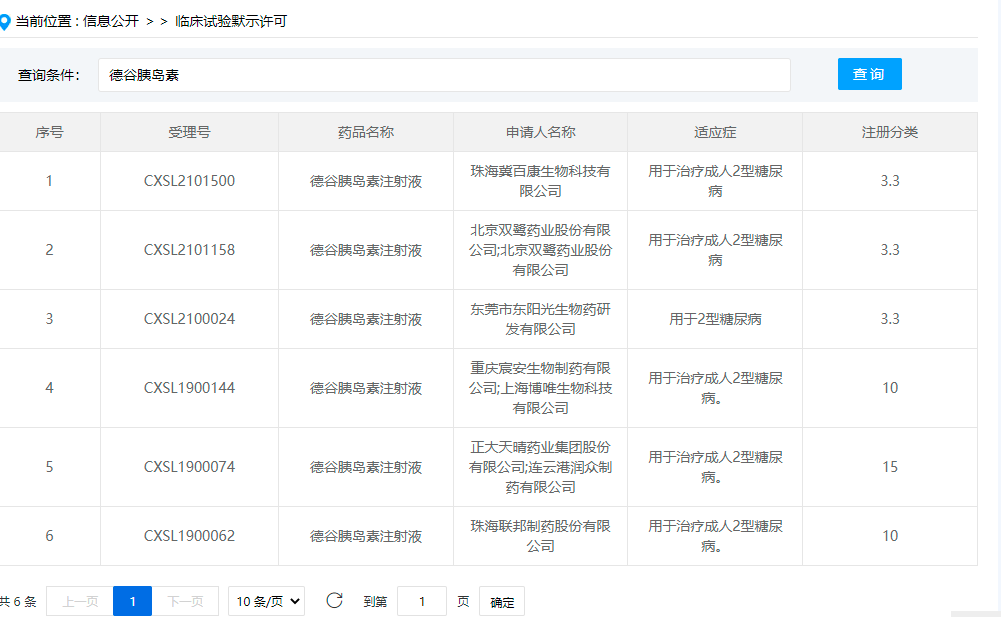
(来源:CDE,临床试验默示许可)
目前,国内已有包括联邦生物、双鹭药业在内的多家药企入局德谷胰岛素、德谷门冬胰岛素生物类似药研发。
其中,四环医药旗下专注于胰岛素产品研发的惠升生物制药研发的德谷胰岛素已完成III期临床,进入报产准备阶段。旗下德谷门冬双胰岛素已取得临床批件,目前正在进行III期临床阶段。
此次发起无效宣告请求的中美华东制药也在研发德谷胰岛素。2017年,华东制药以8000万元受让了旗下子公司九源基因拥有的利拉鲁肽新药技术,并在2021年递交了上市申请,成为国内首家申报利拉鲁肽生物类似药上市并获受理的公司。

中国药品专利公示信息
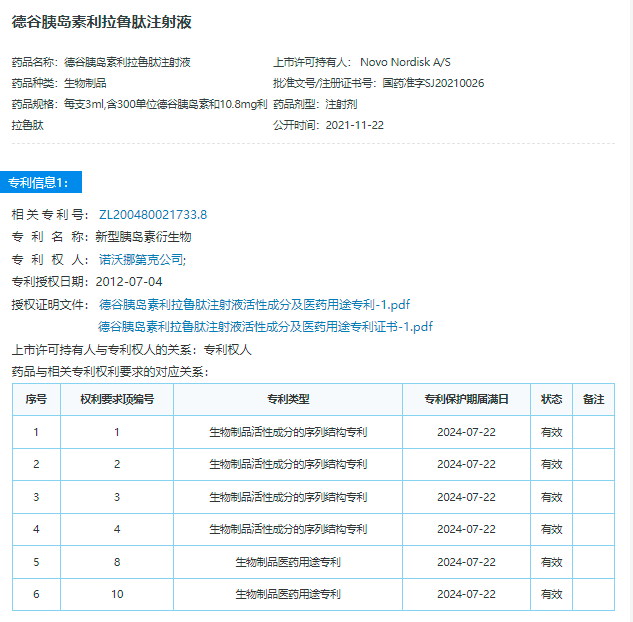
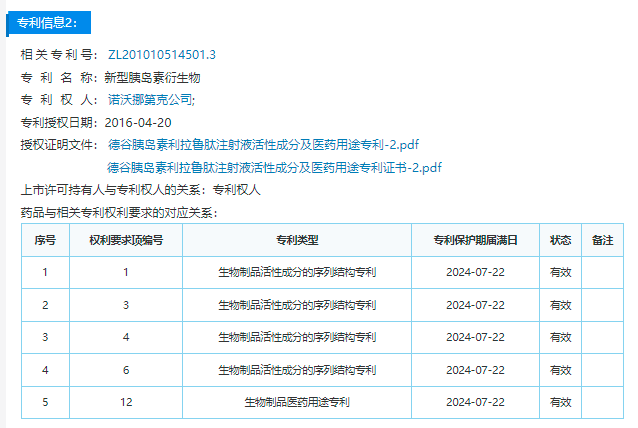

相关药品专利挑战信息
本次口审公告涉及的是上文所示药品专利信息公示中的第一个核心专利,即200480021733.8“新型胰岛素衍生物”,而另一个核心专利ZL201010514501.3“新型胰岛素衍生物”专利则已经在2022年1月17日被吉林惠升生物制药有限公司(下称惠升生物制药)提起过无效宣告请求。
惠升生物制药的无效理由为:专利权利要求1、3-4、7、9-13不符合专利法第22条第2款的规定,权利要求1-13不符合专利法第22条第3款的规定,请求宣告本专利权利要求1-13全部无效。
该案审理过程中,3月8日,诺和诺德公司提交了涉案专利权利要求的修改替换页。具体修改为:删除权利要求1-7以及权利要求8中除NεB29-(Nα-(HOOC(CH2)16CO)-γ-Glu-N-(γ-Glu))des(B30)人胰岛素以外的技术方案;相应地修改了权利要求的编号和引用关系。
经合议组核实,专利权人所作的修改属于权利要求的删除、技术方案的删除和权利要求的进一步限定,符合《专利审查指南》关于无效阶段权利要求书修改的相关规定。
口审阶段,请求人惠升生物制药确认在该修改文本的基础上,不再坚持其无效理由。5月27日,合议组做出复审决定,根据当事人处置原则,维持该专利有效。

扫描上方二维码,
获取该案专利复审文书
从结果来看,本次整理口审公告涉及的两个药品专利权人在面对药品核心专利无效申请时均曾采用了删除权利要求的策略,并均取得了专利维持有效的“暂时性胜利”。但同时也应看到,挑战方的布局能力以及步步紧逼进一步缩小药品专利保护范围的努力结果不容小觑,而在众多前赴后继的挑战者中,谁能最终拔得头筹,且让我们拭目以待。知产力MED+将继续关注相关案件进展。
参考资料:
[1]中国首个帕妥珠单抗生物类似药来了https://mp.weixin.qq.com/s/JhaUuVVob7x5J8ZX_LqCig
[2]国内首个SGLT2抑制剂:达格列净片,迎扎堆申报!18亿降糖药,
https://baijiahao.baidu.com/s?id=1728963856591500929&wfr=spider&for=pc
[3]国内首仿药挑战诺华美国专利!诺华已展开反击,https://mp.weixin.qq.com/s/HS0JDCBdqwnuXxtugiluZg
[4]沙库必曲,https://www.chemicalbook.com/NewsInfo_642.htm
[5]PTAB Institutes Sixth IPR on a Tocilizumab Patent Challenged by Fresenius
https://www.jdsupra.com/legalnews/ptab-institutes-sixth-ipr-on-a-8953971/

(图片来源 | 网络)



















