浅谈国内医药创新知识产权保护的困境与破局
在我国医药产业和医药知识产权高速发展的同时,目前国内医药创新知识产权保护也面临着一些困境。
中国的医药产业作为保障人民生命健康的重要支柱之一,伴随着我国改革开放,取得了突飞猛进的发展。作为与医药产业发展重要相关的医药创新知识产权保护也随着我国知识产权制度尤其是专利制度的建立,取得了巨大发展并得到了国内外广泛认可。但在我国医药产业和医药知识产权高速发展的同时,目前国内医药创新知识产权保护也面临着一些困境,其主要体现在:
 第一,众多创新药专利被无效。
第一,众多创新药专利被无效。
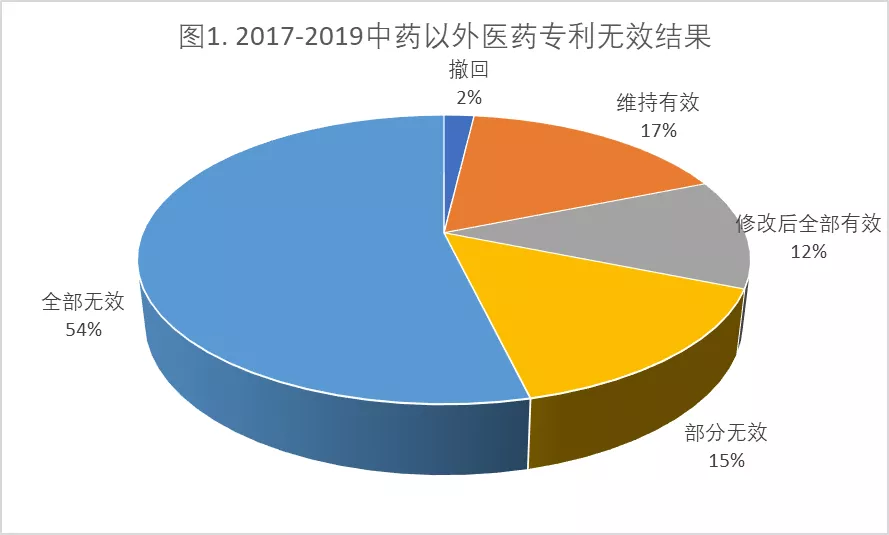
在我们统计的2017-2019年审结的106件生物医药领域专利(不完全统计,不含中药专利)中,被全部无效的专利比例高达54%,全部无效加部分无效的专利占69%(见下图1)。
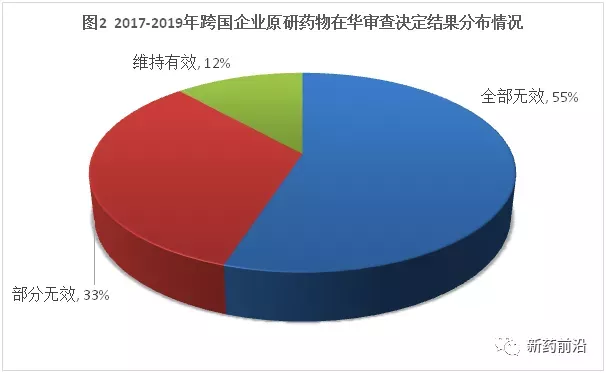
这与公众号“新药前沿”今年4月26日发布的“过去3年38款原研药在华遭遇专利无效挑战:55%全部无效”一文结果类似(见下图,来自“新药前沿”)
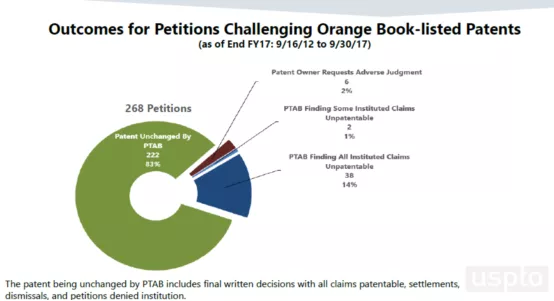
相比之下,尽管美国专利无效IPR程序被认为是“专利杀手”,但在美国专利无效IPR程序从2012年1月16日到2017年9月30日对桔皮书所列医药专利提起无效的统计结果中,83%的专利被全部维持有效(包括最终决定认定所有权利要求有效的、和解的、在无效初期无效请求被驳回的专利),仅14%的专利被全部无效,详见下图(数据和图来源于美国专利商标局网站)。
这种对比一定程度上反映了医药专利权人在我国专利无效过程中担忧和焦虑的原因,即:在我国专利确权程序中医药专利的高无效率。
 第二,在基础专利有效情况下仿制药强行仿制越来越普遍。
第二,在基础专利有效情况下仿制药强行仿制越来越普遍。
从2019年年初至今,国内已有十多个仿制药在原研药相关化合物专利依然有效的情况下获得上市许可。例如维格列汀的化合物专利经过多轮无效仍维持有效,于2019年12月9日到期,但2019年3月6日和2019年3月20日即有两个不同厂家的仿制药获批上市。
2019年6月18日最高人民法院在(2019)最高法民申2178号一案中裁定,仿制药厂向药品评审中心申请注册涉案仿制药,该行为在本质上系请求行政机关给予行政许可的行为,并不属于专利法第十一条第一款中规定的“实施专利”的行为,故不构成侵害专利权的行为。而且,最高院认为,根据专利法第六十九条第五项(即所谓“Bolar例外”)规定,在向药品评审中心申请注册涉案仿制药过程中,即使仿制药厂实施了制造、使用、进口涉案专利药品等行为,只要其仅是为了提供主管行政机关需要的信息而实施上述行为,该行为也不应被视为侵害涉案专利权的行为。
此前的《药品注册办法》第十九条规定,对他人已获得中国专利权的药品,申请人可以在该药品专利期届满前2年内提出注册申请。国家食品药品监督管理局按照本办法予以审查,符合规定的,在专利期满后核发药品批准文号、《进口药品注册证》或者《医药产品注册证》。在这里有两条明确要求:(1)仿制药注册申请只能在药品专利期届满前2年内提出;(2)药监局应当在专利期满后才能批准仿制药注册申请。但2020年1月22日公布的修改后《药品注册办法》删除了这些规定。
因此,按照当前的专利法和新修改的药品注册办法,在原研药基础专利有效的情况下国家药品监督管理局批准仿制药看起来不存在法律障碍。
以上两个方面给原研药企业带来巨大困惑,严重背离医药创新的特点和规律,理由是:
首先,新药开发投入大、周期长、风险高,原研药企业很难在20年的基础专利期限获得合理的收益回报,更不用说医药专利被频频无效。
第二,“Bolar例外”允许仿制药企业为药品注册实施专利却免于侵犯专利权,原研药企业对此没有获得任何回报。
第三,仿制药企业在专利有效的情况下可毫无障碍获批上市,原研药企业无法采取任何行动,只能在仿制药企业发生为许诺销售、销售等实施专利的行为后才能提起法律诉讼。
第四,仿制药企业在专利有效的情况下获批上市后可参与带量采购、招标挂网采购等市场推广,甚至可能冒险制造和销售,由于目前专利侵权诉讼周期长,赔偿低,难以获得诉前诉中临时禁令,诉讼结束时专利可能已过期,而原研药通常在专利临近到期的最后几年才是获得利益回报的关键时期,因此原研药即使提起诉讼也难以及时阻止仿制药侵权、避免巨额损失,因而愈加难以获得合理回报。
面对以上困境,本文作者认为,要解决上述困境,需要从新时代的要求、专利制度的初心出发,基于新药研发的特点和规律,以是否激励创新主体长期投入新药研发作为专利政策是否适当的标准,适度调整专利授权确权标准,加强专利保护。
一、创新是引领发展的第一动力,加强知识产权保护是提高中国经济竞争力最大的激励
十九大报告指出,实现“两个一百年”奋斗目标、实现中华民族伟大复兴的中国梦,必须坚定不移把发展作为党执政兴国的第一要务,坚持解放和发展社会生产力。我国经济已由高速增长阶段转向高质量发展阶段,正处在转变发展方式、优化经济结构、转换增长动力的攻关期,建设现代化经济体系是跨越关口的迫切要求和我国发展的战略目标。必须坚持以供给侧结构性改革为主线,推动经济发展质量变革、效率变革、动力变革。而创新是引领发展的第一动力,是建设现代化经济体系的战略支撑。
同时,社会主义市场经济体制改革必须以完善产权制度和要素市场化配置为重点,实现产权有效激励。习近平总书记在博鳌亚洲论坛2018年年会开幕式发表主旨演讲,强调“加强知识产权保护是完善产权保护制度最重要的内容,也是提高中国经济竞争力最大的激励”。“两个最”的重要论述,站在全局和战略的高度,将知识产权保护提升到了前所未有的高度。2019年11月中办、国办印发的《关于强化知识产权保护的意见》再次强调了这一论断。
二、没有有效专利保护就没有医药创新
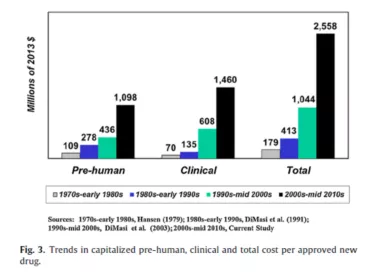
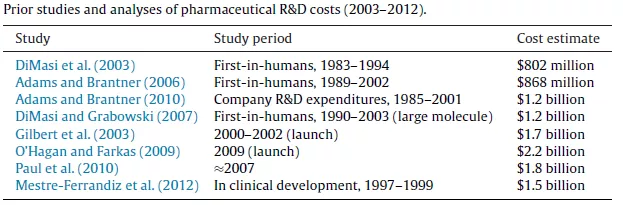
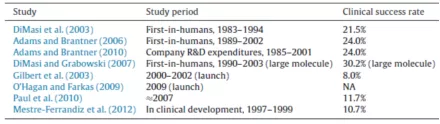
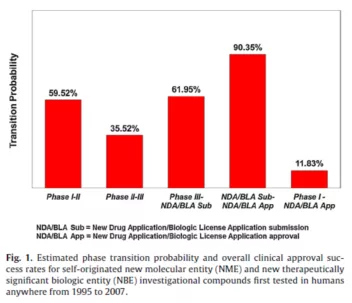
新药开发对专利具有独一无二的高度依赖性,原因在于药品研发投入占销售额比例高,而且远远高于全部行业的平均值,每个药品投入在2010年左右可高达25.58亿美元,而研发产出比在各个行业中是最低的,1995-2007年总体临床试验成功率平均仅为约11.83%(意味着约88%的药品在临床试验中夭折)甚至更低,从药物发现到获得上市审批可达14.5年,且与智能手机等领域一个产品动辄有上千个专利不同,每个药品列入FDA桔皮书的专利平均只有2.7个。因此,医药行业对专利保护高度依赖,可以说没有有效的专利保护就没有医药创新。
1.药品研发投入高、产出低
研究(见DiMasi等2016,如上图)显示,每个新药的总研发费用从上个世纪70年代的1.79亿美元增长到2010年左右的25.58亿美元。这与其他一系列研究相吻合:
(来自DiMasi等2016)
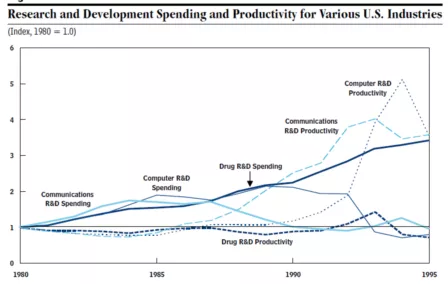
根据PhRMA的统计,药品研发投入占销售额的12-20%,远远高于包括计算机和通讯在内的其他行业,实际上全部行业的平均值仅为约4%(见下图)。可见在所有行业中,医药领域是研发投入最密集的行业。
(来自CONGRESS OF THE UNITED STATES,CONGRESSIONAL BUDGET OFFICE,Research and Development in the Pharmaceutical Industry,October 2006)
注:PhRMA 为Pharmaceutical Research and Manufacturers of America ,NSF 为National Science Foundation。NSF的测算与PhRMA的数据相比较低,部分原因是NSF把非处方药例如维生素、OTC药等非专利药也统计在内。
从下图可以看出,在所有行业中,药品行业研发投入在不同时期均处于高位,但研发产出比处于最低。
(来自CONGRESS OF THE UNITED STATES,CONGRESSIONAL BUDGET OFFICE,Research and Development in the Pharmaceutical Industry,October 2006)
2.药品研发风险高、成功率低、获批率更低
(来自DiMasi等2016)
研究显示(见上图),临床试验成功率从上个世纪80-90年代的21.5%以上降低到2000年以后的8-11.7%。DiMasi等(2016)测定的1995-2007年总体临床试验成功率(进入临床试验的候选药品最终被批准的概率)为11.83%(见下图)。
(来自DiMasi et al.,2016)
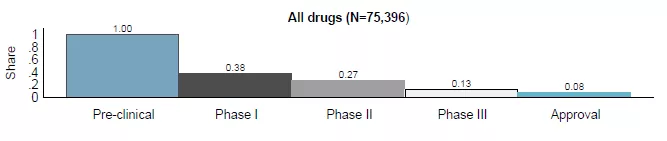
Gaessler等(2019)指出,75,396种药品候选物总体临床试验成功率为8%。
(来自Gaessler等(2019))
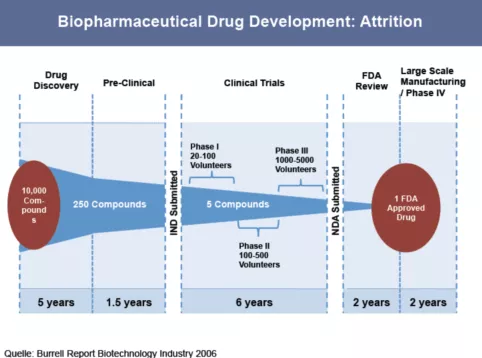
3.药品研发周期长
(来自Neal G. Simon, October 17, 2014,Drug Discovery and Development)
研究显示(Simon 2014,上图),药物发现、临床前研究、三期临床试验、药监局审批和大规模生产上市五个阶段。从药物发现到获得上市审批可达14.5年,需要筛选平均1万个化合物才能获得1个批准上市的药物。
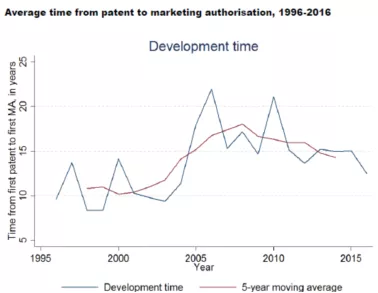
欧盟统计的从基础专利申请提交到新药获批上市的时间为约15年(见上图)。见Study on the economic impact of supplementary protection certificates, pharmaceutical incentives and rewards in Europe,2018,by Copenhagen Economics。
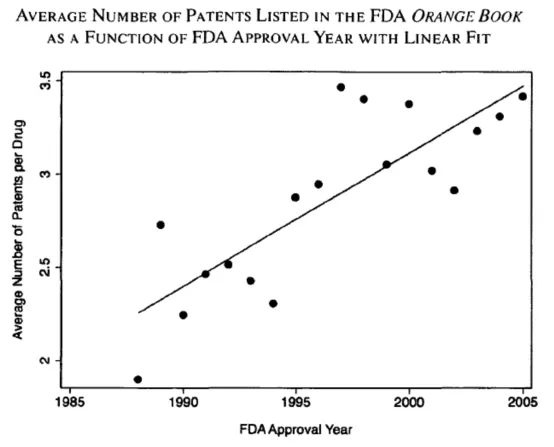
4.每个药物的专利数量少
与智能手机等领域一个产品动辄有上千个专利不同,在美国FDA批准的药物中,每个药品列入桔皮书的专利平均只有2.7个专利(见Drug Pricing and Pharmaceutical Patenting Practices,February 11, 2020)。下图也清楚地显示了1985-2005年每个药品的平均专利数:
(来自Ouellette 2010)
可见,新药研发投入高、产出低,风险高、成功率低、研发周期长、专利数少,对专利保护具有独一无二的高度依赖性。
三、加强医药专利保护适逢其时
我国医药市场规模已成为全球第2大医药市场,我国对全球医药研发的贡献上升到4%—8%, 跨入第二梯队,仅次于美国、日本,我国新药在研企业数量位居全球第3位,我国启动的临床试验数量位居全球第4,我国拥有的生物类似物研发数量位居世界第1,我国申请人提交的小分子药、生物药中国发明专利申请数量已超过国外申请人在华提交的专利申请总数,PCT专利申请数量仅次于美国,国产化药和生物药创新药注册申请近几年持续较快增长,至2017年底已获批国产“1类”小分子化学药物共13个、生物药23个,因此,加强医药专利保护适逢其时。以下对此进行详细说明。
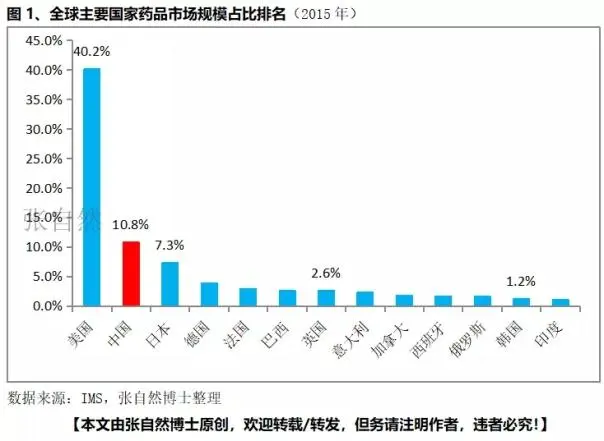
中国的医药市场规模已超越日本成为全球第2大医药市场,2015年中国医药市场规模已占了全球的10.8%(据张自然2018,见下图)。
据参考消息,2018年,中国药品市场规模为1279亿美元,据估计,到2023年将达到1618亿美元,占据全球市场30%的份额。
2018年7月19日,“2018年《财富》世界500强排行榜名单”正式发布,全球共有13家制药企业上榜。其中,中国华润和中国医药集团2家中国药企入榜,分别位居第86位和194位(据张自然2018)。
自2015年国务院44号文发布以来,中国掀起了旨在创新和与国际接轨的药监改革,并已取得了阶段性成果,使中国医药产业的综合竞争能力,尤其研发实力大幅提升。
麦肯锡与RDPAC 2019年共同发布的数据显示,至2018年,中国对全球医药研发的贡献上升到4%—8%, 跨入第二梯队,仅次于美国、日本(见2019中国医药企业品牌影响力排行榜)。
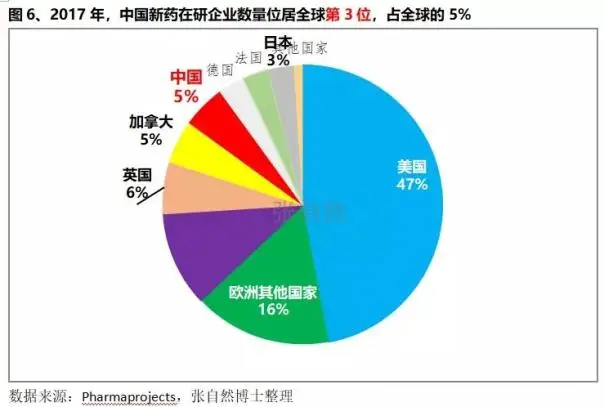
1、中国新药在研企业数量位居全球第3位
2016年中国即已成为亚洲最大的医药创新基地。截止2018年1月,全球有新药研发的医药企业共4134家(按总部所在国家/地区划分),其中,中国拥有新药研发企业的数量和加拿大并列第3位,占5%(据张自然2018)。
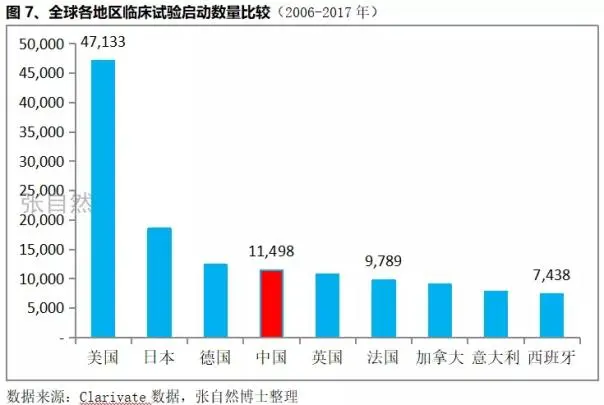
2、中国启动的临床试验数量位居全球第4
(来自张自然2018)
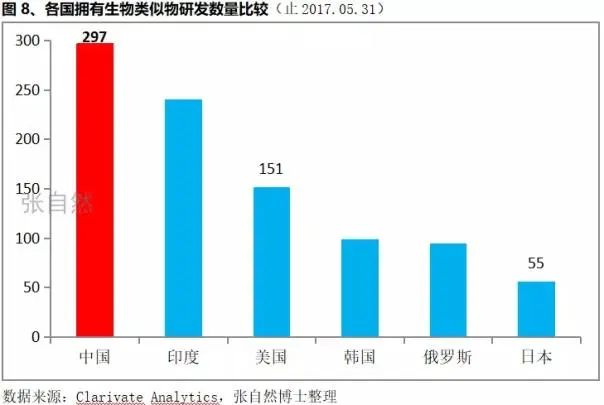
3、中国拥有的生物类似物研发数量位居世界第1
在小分子药物研发方面,中国与发达国家的差距还很大,但生物药研发全球起步都较晚,且恰在此时,中国的整体国力大幅提升、启动了空前的药监改革以及大量海归科学家回国加入到新药创新行列等因素,使中国的生物医药研发得以快速发展,中国已是拥有生物类似物研发数量最多的国家(据张自然2018,见下图)。
4、我国医药专利申请数量快速增长
我们对小分子药、生物药的中国发明专利申请和PCT申请进行统计,发现各类情形下我国申请人提交的专利申请数量均快速增长。
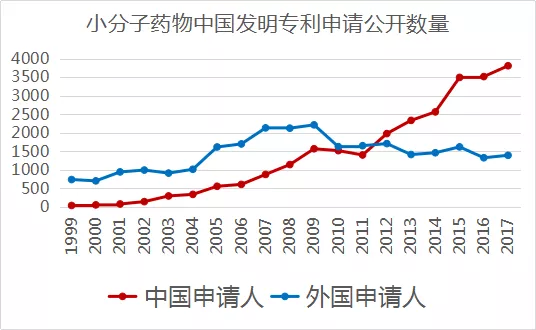
按小分子药物中国发明专利申请公开数量计算,中国申请人提交的申请数在2012年已超过国外申请人在华提交的申请总数,见下图:
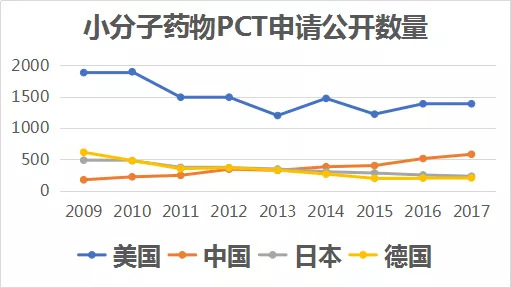
按小分子药物PCT专利申请公开数量计算,中国申请人提交的申请数在2014年达到世界第二,仅次于美国,而且与美国的差距持续缩小,见下图:
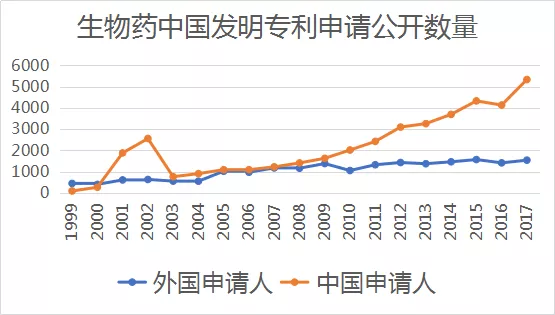
按生物药中国发明专利申请公开数量计算,中国申请人提交的申请数在2009年开始已超过国外申请人在华提交的申请总数,并持续快速增长,见下图:
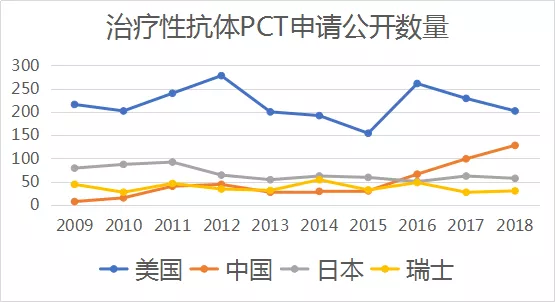
按治疗性抗体PCT专利申请公开数量计算,中国申请人提交的申请数在2016年达到世界第二,仅次于美国,而且与美国的差距持续缩小,见下图:
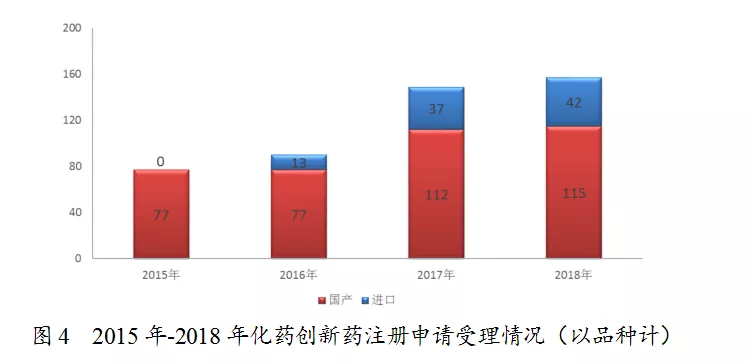
5、国产1类化药、生物药创新药注册申请稳步增长
根据药监总局2018年药品评审报告,药审中心2018年受理的157个1类化药创新药注册申请中,国产化药创新药注册申请为115个品种,近几年持续较快增长,见下图:
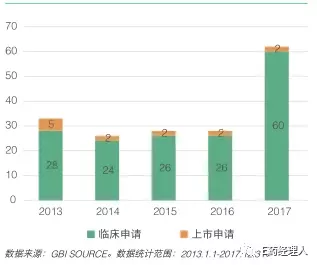
国内受理的国产生物1类药申请也稳步增长,见下图(来源于E药经理人https://mp.weixin.qq.com/s/ioytvxTStize95kSonE3tQ)
通过药渡数据及其他专业数据库共同查询汇总,通过药渡数据查询,从2002年至2017年,由我国本土企业自主研发,后经CFDA批准上市的“中国1类”小分子化学药物,共13个。自2001年至2017年,由我国本土企业自主研发,后经食药监总局批准上市的“中国1类”大分子生物药,共23个(见强森,2017)。
可见,我国新药自主创新能力近年来有明显加强,当前正是加强医药专利保护以激励创新药研发投资的绝佳机会。
我们很高兴地看到,许多国内药企特别是新兴创新药企业纷纷希望加强知识产权保护。全国人大代表、江苏恒瑞集团董事长孙飘扬多年在两会上提案呼吁加强知识产权保护,包括专利延长和数据保护。而全国人大代表、陕西步长制药有限公司董事长赵超看来,加强知识产权保护是激励企业增加创新投入的有效手段。
四、加强医药创新专利保护的具体建议
从上面的分析看,加强医药创新的知识产权保护,既是历史责任,也是现实需要,正逢其时。针对创新药专利无效率高和仿制药强行仿制这两大困局,有必要通过进一步加强知识产权保护来破局,包括建立专利期延长制度、专利链接制度和完善临床实验数据保护。限于篇幅,本文仅讨论如何确立恰当的医药专利授权确权标准以从源头加强医药专利的保护,不讨论专利期延长、专利链接和临床实验数据保护等其他知识产权保护措施。
1.以是否能激励创新主体长期投入新药研发作为专利政策是否适当的标准
美国著名法学家和美国联邦上诉法院法官杰罗姆·弗兰克(Jerome Frank)1942年曾写道,专利系统支持者和攻击者争议的问题——刺激发明——可能并非问题所在,真正的问题可能是刺激投资。
如上文所讨论的,每一个新药开发平均高达一二十亿美元的研发投入,高达约88%的新药在临床试验中夭折,从药物发现到获得上市审批可达14.5年,如果没有可观的回报预期,没有人会投资到新药开发中。而专利制度的根本意义就在于为创新主体提供一定期限的市场独占权以获得投资回报,来刺激对创新的投资,达到鼓励创新,发展生产力的目的。因此,要判断我国医药专利制度是否适当,首先要看是否激励创新主体长期投入新药研发。
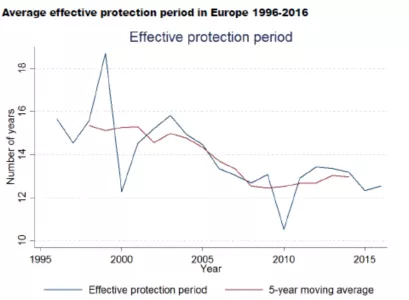
新华社瞭望智库2018年9月29日发表的文章“坐拥7000多家药企,生产166138种药,中国为什么还会缺创新药?”指出, 从“药物研发-审批上市-市场销售-药物研发”的全链条看,美国通过专利补偿制度,使药物上市后的专利保护期延长到平均14年左右,研发企业就可从中获得更多利润,从而具有更强的经济实力和兴趣开展新的药物开发。同样,在欧洲,药物上市后平均也有13年的有效保护期限(包括专利期限、SPC、临床实验数据保护等,见下图)。
(来自Study on the economic impact of supplementary protection certificates, pharmaceutical incentives and rewards in Europe,2018,by Copenhagen Economics。)
完成药品整个生命周期大致在25-30年左右,才能实现新药的盈利和新药研发的再投资。但目前中国还没有进行过药物整个生命周期的研究,使产品上市后获得较时间保护期,从而让企业增加创新收益的机制,也尚未形成。因此,迫切需要我国调整专利政策以适应新药创新的需要。
为了达到平均13-14年的药品上市后有效专利保护期,首先要调整医药专利授权确权标准,使得药物基础专利(即化合物专利)通常较为稳固,并保护有实质进步的次级专利。
2.确保基础专利通常稳定,并保护有实质进步的次级专利
没有稳定的专利,谈不上专利权的保护。
医药领域专利一般可分为两类:一类是保护药品活性成分的产品专利,通常称为基础专利或化合物专利,另一类是保护药品其他改进的专利,常常称作次级专利,也被称作二代专利或改进专利。因为化合物专利是相关药品提交的第一个专利,保护药品的核心——活性成分,因此,化合物专利对于药品的重要性是不言而喻的,药品专利保护期限的时钟也就从化合物专利的提交之日开始响起。
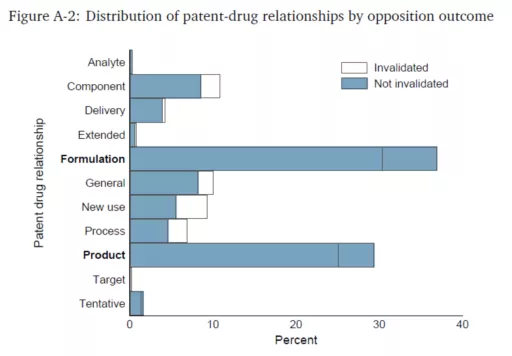
在欧盟调查的2000-2007 EPO医药专利异议程序中,被无效的专利绝大部分都是次级专利,仅极个别的情况有化合物专利被无效的(见Pharmaceutical Sector Inquiry,EU Commission, 2009)。同样的结果可见于Gaessler(2019)等(见下图)。
在美国也存在同样的情况,例如在本文开头提到,即使包括全部化合物专利和次级专利在内,美国IPR无效程序仅14%的药品专利被全部无效,88%专利被维持。因此,维持化合物专利较高的稳定性是达到平均13-14年的药品有效专利保护期的基本前提。
在我们不完全统计的2017-2019年药物化合物专利无效决定中,37%-43%的专利被全部无效或部分无效,而未修改或者经修改后全部维持有效的专利占57-63%。因此,需要进一步提高化合物专利的维持比例。
另外,次级医药发明具有实质进步时,往往能显著改进疾病治疗效果、促进人类健康,因而也应当予以鼓励和保护。例如,特定疾病亚型、新发现的疾病类型和亚型、给药对象、给药方式、途径、用量及时间间隔等药物使用方法有关的特征常常对疾病治疗用途的效果产生重要影响,是医药用途发明的重要方面。当申请人通过改变给药特征显著改进疾病治疗效果、促进人类健康的情况下,不考虑这些所谓“给药特征”不利于医药工业的发展及人民群众的健康需要,也不符合专利法的宗旨。因此,建议规定特定疾病类型和亚型、新发现的疾病类型和亚型、给药对象、给药方式、途径、用量及时间间隔等用药有关的特征对医药产品(如化合物或组合物权利要求)或者化学产品的医药用途发明(制药用途权利要求)具有限定作用,能使该产品或用途具有新颖性,克服当前专利审查指南中对此类发明不予保护的缺陷。
3.发明“充分公开”应以“能够实现”而不是是否有数据作为判断依据
根据专利法第二十六条第三款,说明书应当对发明作出清楚、完整的说明,以所属技术领域的技术人员能够实现为准。可见,“所属技术领域的技术人员能够实现”是判断说明书是否充分公开的标准。
该判断标准的主体是所属技术领域的技术人员,他具有一定的知识水平和认知能力。化学、生物、医药领域的技术人员具有应用申请日前该领域常规实验手段的能力。如果本领域技术人员按照说明书公开的内容,经过有限试验、无需创造性劳动就能够再现发明的技术方案,实现发明的技术效果,则应该认为满足了“能够实现”的要求。这应该是充分公开的合理标准。
对发明公开程度的要求和发明点(或发明贡献)密切相关。根据专利法第二条,发明是指对产品、方法或者其改进所提出的新的技术方案。
对于化学产品发明,发明的技术方案是产品,发明对现有技术的贡献主要是提供一种新的、非显而易见的产品,效果是辅助的,主要作用是为了说明产品有用。因此,化学产品发明的充分公开应以产品的结构和制备方法为主,效果为辅。故此,并不必需在申请说明书中过分强调记载效果数据。
例如,对于化合物发明,发明的主要贡献是提供新的、非显而易见的化合物。因此,化合物发明的充分公开应以化合物的结构和制备、鉴定为主。效果主要是说明化合物有用,不应要求在说明书中必须提供数据来证明。
对于化学方法、用途发明,发明的技术方案是方法、用途,发明对现有技术的贡献主要是提供一种新的方法、用途,效果本身往往就是技术方案(方法、用途)的一部分。因此,化学方法、用途发明的充分公开通常应包括效果的充分公开,达到本领域技术人员能够实现的程度。
例如,对于医药用途发明,发明的主要贡献是提供新的、非显而易见的医药用途(例如治疗疾病),医药用途技术方案本身就包含了效果(即治疗有效),在说明书中应充分公开效果,通常应提供初步证据。
因此,对于化学产品的充分公开要求,建议删除《审查指南》第二部分第十章第3.1节“化学产品发明的充分公开”关于说明书应当记载定性或者定量实验数据的规定。
4.允许一定条件下补充实验数据证明专利性
当前审查指南第二部第十章3.5节规定“补充实验数据所证明的技术效果应当是所属技术领域的技术人员能够从专利申请公开的内容中得到的”。作者建议将其修改为“补充实验数据所证明的技术效果应当是所属技术领域的技术人员通过有限的试验、不需要创造性能够从专利申请公开的内容中得到的。在药品专利申请中,当用于证明发明的创造性时,补充实验数据所证明的技术效果还可以是与原始申请文件中所记载或提示的技术问题相关的技术效果”。
对上述修改具体说明如下:
(1)第一点修改“补充实验数据所证明的技术效果应当是所属技术领域的技术人员通过有限的试验、不需要创造性能够从专利申请公开的内容中得到的”。
因为这种技术效果在说明书中已经得到充分公开,本领域技术人员根据原始申请文件即能够实现,补充实验数据并不加入说明书中,只是用于佐证该技术效果,因此,并不违背“先申请制”。
基于同样的理由,对于佐证原始申请文件已经充分公开的技术效果的补充实验数据,无论用于证明权利要求得到说明书的支持、公开和还是用于证明创造性,都应该允许。
上述标准已经排除了人们担忧的所谓跑马圈地的可能性。当一项专利申请仅仅公开了涵盖巨大数量化合物的马库什通式,而没有具体化合物合成,或者用途发明仅仅罗列了大量疾病名称,而没有较为具体的用途或效果描述时,本领域技术人员按照说明书公开的内容,难以经过有限试验再现发明的技术方案,实现发明的技术效果。
基于这一标准,根据发明点(发明类型)的不同,如果说明书公开的程度满足了“能够实现”的标准,即本领域技术人员按照说明书公开的内容,经过有限试验、无需创造性劳动就能够再现发明的技术方案,实现发明的技术效果,则如下三种情形的技术效果均应当认为是“能够得到”:原始申请文件仅仅文字记载了所述技术效果,虽然没有明确记载但是根据现有技术可以预期所述技术效果,以及虽然没有明确记载但与公开的技术效果存在关联。
应当注意,不同类型发明中效果所起的作用不同,对于证明效果的数据要求也不应相同。化合物发明的效果主要是证明化合物有用,证明效果的数据并非充分公开的一部分,而用途发明的效果是技术方案的一部分,因而需要公开到本领域技术人员能够实现的程度。
为了帮助阐明上述修改建议,特举例如下。建议以下情形一般认为应允许补充试验数据:
例1:发明涉及具有医药用途的新的化合物,说明书中描述了该化合物的具体医药用途或效果,申请人提交补充实验数据用于验证该用途或效果,或者用于证明该用途或效果比现有技术更好。
例2:发明涉及具有医药用途的新的化合物,说明书中描述了发明化合物的效果数据范围,申请人提交补充实验数据用于验证具体化合物的效果,或者用于证明具体化合物的效果比现有技术更好。
例3:发明涉及二次医药用途,说明书提供了该用途的初步证据,申请人提交补充实验数据用于验证该用途或其效果,或者用于证明该用途或其效果比现有技术更好。
例4:专利申请提及发明化合物从较高浓度到较低浓度均有活性,提供了一些化合物在较高浓度下有活性的数据,但未提供这些化合物在较低浓度下的活性数据,申请日后补充这些化合物或结构类似化合物在较低浓度下活性的数据,显示比现有技术化合物更好。
例5:发明涉及增效组合物,说明书提供了初步证据,申请人提交补充实验数据用于验证该增效作用,或者用于证明该增效作用比现有技术更好。
(2)第二点修改“在药品发明专利申请中,当用于证明发明的创造性时,补充实验数据所证明的技术效果还可以是与原始申请文件中所记载或提示的技术问题相关的技术效果”。
专利制度通过给予专利权人在专利权期限内独占发明的权利,保证发明创造活动得到一定回报,来鼓励发明创造。但药品发明的研发和实施与其他发明有显著的不同。如上文所述,专利药品上市之前需要经历漫长的过程,专利药品不可能像其他领域专利一样在提交专利申请之时已经基本完成产品上市的主要研究工作。相反,专利药品的大部分有待生命体内验证的研究工作都是申请日之后完成的,这些申请日之后完成的研究工作是实施发明(药品上市)所必需的监管要求及最终上市产品安全性和有效性的要求,同时也需要投入更多人力、物力和时间才能完成,但这些都根植于申请日提交的原始申请文件描述的发明构思和技术方案,解决原始申请文件所记载或提示的技术问题所必然涉及的相关技术效果,该相关技术效果与原始申请文件记载的技术效果或技术问题具有本领域普通技术人员能认知的高度技术相关性。因此,如果不允许药品申请人提交申请日后与原技术问题相关的技术效果,则将导致药品专利申请很多难以获得授权,也难以有与其他领域相同的、平等的机会获得专利保护,最终达不到在药品领域鼓励发明创造的目的。
因此,建议在药品专利申请审查程序及无效程序中允许补充实验数据证明与原始申请文件技术问题相关的技术效果。
综上所述,药品研发投入高、周期长、风险高、专利依赖度高,而加强药品创新知识产权保护正逢其时,我们应高瞻远瞩,目光长远,针对药品领域制定相应的专利政策,包括授权确权标准的调整,以是否激励创新主体长期投入新药研发作为专利政策是否适当的标准,不局限于当前的、局部的利益,着眼于今后五年、十年、二十年医药创新蓬勃发展,假以时日,我国医药行业一定能和其他领域一样,成为创新强国的重要技术领域之一。
1. 2018年药品评审报告。2. 2019中国医药企业品牌影响力排行榜。3. CONGRESS OF THE UNITED STATES,CONGRESSIONAL BUDGET OFFICE,Research and Development in the Pharmaceutical Industry,October 2006。4. DiMasi, J.A. et al.,2016,Journal of Health Economics 47 (2016) 20–33。5. Drug Pricing and Pharmaceutical Patenting Practices,February 11, 2020,Congressional Research Service,https://crsreports.congress.gov。6. E药经理人https://mp.weixin.qq.com/s/ioytvxTStize95kSonE3tQ7. Gaessler, Fabian; Wagner, Stefan (2019): Patents, data exclusivity, and the development of new drugs, Discussion Paper, No. 176, Ludwig-Maximilians-Universität München und Humboldt-Universität zu Berlin, Collaborative Research Center Transregio 190 - Rationality and Competition, München und Berlin。8. Ouellette, Lisa L.,How Many Patents Does It Take to Make a Drug - Follow-On Pharmaceutical Patents and University Licensing, 17 Mich. Telecomm. & Tech. L. Rev. 299 (2010).9. Pharmaceutical Sector Inquiry,EU Commission, 200910. Simon, Neal G.,October 17, 2014,Drug Discovery and Development。11. Study on the economic impact of supplementary protection certificates, pharmaceutical incentives and rewards in Europe,2018,by Copenhagen Economics。12. 美国著名法学家和美国联邦上诉法院法官杰罗姆·弗兰克(Jerome Frank)1942,“The controversy between the defenders and assailants of our patent system may be about a false issue – the stimulus to invention. The real issue may be the stimulus to investment.”13.强森,2017,药渡,可参见https://med.sina.com/article_detail_103_2_39101.html 和https://www.sohu.com/a/213736162_269522
14. 微信公众号“新药前沿”2020年4月26日发布的“过去3年38款原研药在华遭遇专利无效挑战:55%全部无效”,链接请见https://mp.weixin.qq.com/s/6lYw19r5msxhx5fidz_zRw
。
15. 新华社瞭望智库2018年9月29日发表的文章“坐拥7000多家药企,生产166138种药,中国为什么还会缺创新药?”16.张自然, 2018,“改革开放40年15图看懂中国医药产业”,中国制药信息,2018(034),012,P.2-5,也见https://med.sina.com/article_detail_103_1_52436.html。