美国专利保护期延长制度管窥(一)
——“专利保护期调整”和“专利保护期延长”的一体两翼制度框架
引言
新颁布的《专利法》可谓是千呼万唤始出来,犹抱琵琶半遮面。第四十二条对中国特色的专利保护期延长制度作了原则性规定,但除了醒目的数字(四年、三年、五年、十四年),对于第二款和第三款的具体关系、适用情形、补偿期限计算方式等仍有待实施细则和具体规定细化。适逢中国专利保护期延长制度行将落地,本文以美国专利及其专利保护期延长的具体情形为例,管窥美国专利保护期延长制度,帮助大家加深对这一新建立制度的理解。
一、新《专利法》对专利保护期延长制度的原则性规定
新颁布的《专利法》第四十二条对中国特色的专利保护期延长制度作了原则性规定。其中第四十二条第二款是专利授权期限补偿,适用于符合条件的所有发明专利,是国务院专利行政部门应专利权人的请求,对专利授权过程中不合理的审查延迟(扣除由申请人引起的不合理延迟)给予其专利权期限补偿。这一规定与美国专利法35 U.S.C. §154的专利保护期调整(Patent Term Adjustment,PTA)制度类似,但使用了更有人文关怀且更为贴切的“补偿”二字,因专利行政审查程序冗长挤占了专利权人实际有效专利保护期的,行政部门依请求给你找补回来。当然,申请人在审查程序中自己耽误的时间,或授权后怠于行使补偿请求权的,不适用该款的专利权期限补偿。
第四十二条第三款特别涉及药品专利期限补偿,是国务院专利行政部门应专利权人的请求,为补偿国务院药品监督管理部门对新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利给予专利权期限补偿。与美国专利法35 U.S.C. §156的专利保护期延长(Patent Term Extension,PTE)制度类似,该款旨在补偿因药品行政审批过程冗长对药品可享有的实际有效专利保护期的挤占。作为药品专利链接制度的有机组成部分,此举在专利保护期延长层面实现了药品与专利行政审批程序的联动。
为了确保上述制度落地,对于适用对象、适用情形、请求时机、计算方式等的实施细则和具体规定正在紧锣密鼓的酝酿之中。恰逢其时,本文以美国专利及其专利保护期延长的具体情形为例,管窥美国专利保护期延长制度,帮助大家加深对这一新建立制度的理解。
二、美国专利保护期延长制度:以一个极典型的美国专利为例[1]
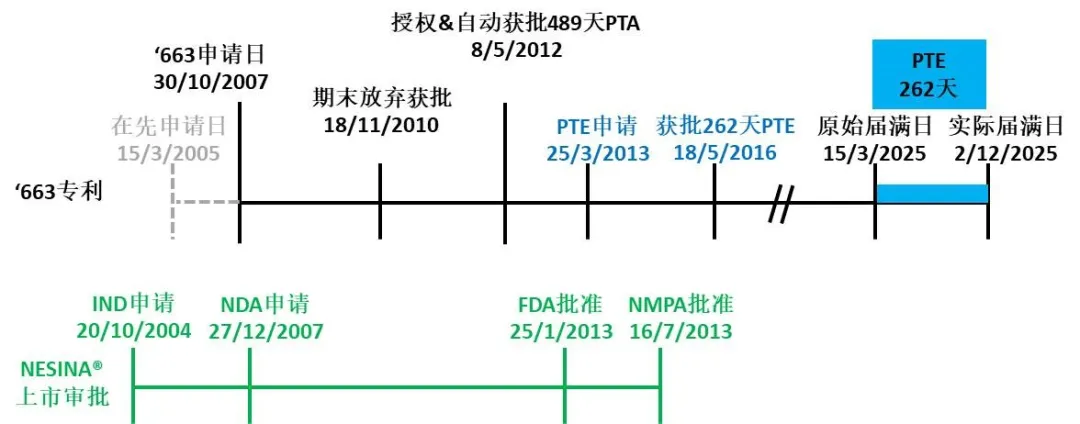
美国专利商标局(USPOT)官网上汇总并公布了基于35 U.S.C. §156获批PTE的专利列表[2],截至目前,该列表中仅有811件专利。美国专利US8,173,663 (以下简称'663专利)是其中一件较新列入的授权专利,该专利对应药品的商品名为NESINA® (alogliptin benzoate) ,中文名为尼欣那(苯甲酸阿格列汀) ,原始专利权届满日为2025年3月15日,获批262天的PTE。
'663专利的保护期延长历程丰富且极具代表性,涉及继续申请(Continuation application)、期末放弃(Terminal Disclaimer,TD)、PTA、PTE、多药品多专利等制度,本文以'663专利为例,以该专利的授权和NESINA的上市申请为线索去串联上述制度,还原专利期限延长的完整场景。
图1. '663专利及NESINA®的行政审批时间轴
三、PTA:USPTO自动给予,但受制于期末放弃
1、期末放弃
'663专利的申请提交日为2007年10月30日,是2005年3月15日提交的在先美国专利申请11/080,992('992申请)的继续申请(Continuation application)。'992申请于2010年10月5日获得授权,其美国专利号为US7,807,689 (以下简称'689专利),并享有PTA 1200天。
由于'689专利不是本文主线,本文不对'689专利着过多笔墨,但其着实对'663专利的保护期延长产生了实质影响。具体而言,'663专利在审查过程中,为了克服非法定重复授权缺陷,提交了期末放弃声明,从而确保与'689专利同时届满。
图2. '689专利的期末放弃(图源:USPTO网站截图)
2、USPTO自动给予PTA
2011年8月26日,USPTO发出授权缴费通知书(Notice of Allowance and Fees Due),指出'663专利基于35 U.S.C. §154(b)享有的PTA为81天。
图3. '689专利初次确认的PTA(图源:USPTO网站截图)
3、继续审查,USPTO最终确认PTA
申请人于2011年12月13日提出继续审查请求(Request for Continued Examination,RCE)。USPTO于2012年4月18日发出授权通知书(Issue Notification),并最终确定'663专利基于35 U.S.C. §154(b)享有的PTA为489天。
图4. '689专利最终确认的PTA(图源:USPTO网站截图)
4、PTA计算方式及信息公示
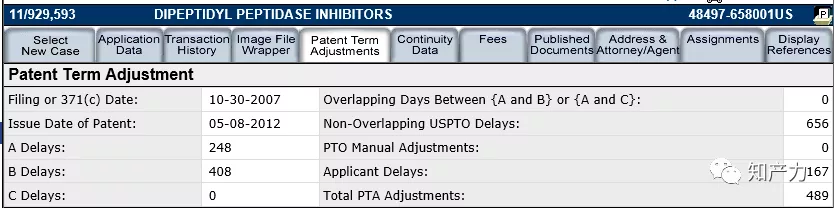
基于美国专利法35 U.S.C. §154,PTA大体由以下方式计算:
图5. PTA计算公式
在USPTO官网的Pair数据库中,可以看到PTA的详细计算依据,包括A类延迟、B类延迟、C类延迟,并由此扣除重叠天数('663专利为0)和申请人延迟。需要注意的是,这里并未体现出期末放弃的信息。
图6. '689专利在Pair数据库中的PTA计算(图源:USPTO网站截图)
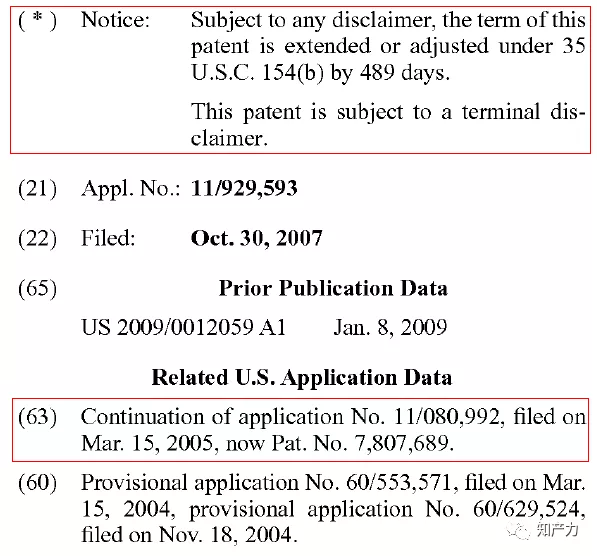
在2012年5月8日的公告文本中,489天的PTA得到确证。但与此同时也明确了其受制于期末放弃(subject to a terminal disclaimer)。根据美国专利法的规定,仅PTA会受制于期末放弃,而PTE则不受其影响。对于'663专利保护期的最终影响我们在后文分析。
图7. '689专利扉页上的著录项目信息(图源:专利公告文本截图)
四、PTE:专利权人申请,USPTO与FDA联动,远比数学运算复杂
1、依专利权人申请启动PTE程序
'663专利涉及药品NESINA®的使用方法,NESINA®于2013年1月25日在FDA获批上市,晚于'663专利的授权日。专利权人依据35 U.S.C. §156(d)(1),于2013年3月25日,即NESINA®获批之日起60天内提出专利保护期延长申请(Patent Term Extension Application Under 35 USC 156),寻求264天的PTE。
2、USPTO与FDA联动—第一轮:确认是否符合延期条件
USPTO就该PTE申请于2014年1月15日首次致函FDA(Initial letter Re: PTE Application to regulating agency),希望确认以下事项:
第一,2013年1月25日,NESINA®与OSENI®和KAZANO®同时在FDA获批上市,且申请人相同。三项NDA的每一项均符合35 U.S.C. §156(a)(5)(A)就首个被批准商业销售或使用的产品的规定。
第二,在此之前,NESINA®经历了35 U.S.C. §156(g)规定的审批程序,并且本次PTE申请于该药品获批之日起60天内提出。
USPTO同时指出,是否批准延期的决定尚未作出,本函不作为35 U.S.C. §156(d)(2)(A)规定的通知。但USPTO亦表明了本专利可以获得PTE的初步意见。
FDA于2014年5月2日复函USPTO(Letter from FDA or Dept. of Agriculture RE: PTE Application),确认以下事项:
第一,NESINA®经历了35 U.S.C. §156(a)(4)规定的审批程序;2013年1月25日同时获批的三种新药申请代表了苯甲酸阿格列汀(alogliptin benzoate)作为活性成分首次被批准商业销售或使用;三项NDA由于部分临床试验相互依赖,因此至少部分审批程序共享。
第二,NDA于2013年1月25日获批,因此2013年3月25日提交的PTE申请符合35 U.S.C. §156(d)(1)药品获批之日起60天内提交申请的规定。
FDA同时要求USPTO在作出批准PTE决定之后通知FDA,继而FDA会根据35 U.S.C. §156(d)(2)(A)的要求,确定新药审批周期,在《联邦公报》(Federal Register)上公布其决定,并通知USPTO。
3、USPTO与FDA联动—第二轮:确认具体的行政审批周期
USPTO于2015年3月18日二次致函FDA(Second letter to regulating agency to determine regulatory review period),告知经USPTO最终审核,'663专利符合(eligible for)PTE条件,并请FDA协助确认具体的行政审批周期。
FDA于2015年4月21日二次复函USPTO(Transaction for FDA Determination of Regulatory Review Period),告知NESINA®经历的行政审批周期总长为3021天,其中1164天发生在试验阶段(testing phase),1857天发生在审批阶段(approval phase)。具体周期对应时间节点如下:
1) 新药临床研究申请(Investigational New Drug Application, IND)生效日:2004年10月20日(不同于申请人主张的2004年10月19日),即FDA收到IND申请后的30天。
2) 新药申请(New Drug Application,NDA)日:2007年12月27日(与申请人主张一致)。
3) 新药申请获批日:2013年1月25日。
4、USPTO与FDA联动—第三轮:行政审批周期公示及据此计算PTE
在2015年5月4日的《联邦公报》上,FDA对NESINA®出于专利保护期延长目的确定行政审批周期的上述情况进行公示。并指出,在此期间,任何人如认为FDA确认的上述时间节点有误,均可于2015年7月6日前要求FDA重新计算。任何利害关系人均可于2015年11月2日前要求FDA就申请人在行政审批期间是否合理尽职进行调查。
图8. FDA在《联邦公报》上对NESINA®行政审批周期情况的公示(图源:USPTO网站截图)
USPTO于2016年5月18日发出最后决定通知书(Notice of Final Determination),认定'663专利涉及人用药品NESINA®的使用方法,符合35 U.S.C. §156规定的PTE条件,专利保护期可延长262天(略短于申请人寻求的264天)。具体计算方法依据FDA于2015年5月4日在《联邦公报》上确定的行政审批周期。根据U.S.C. §156(c):
图9. PTE计算公式
由于行政审批始于2004年10月20日,早于专利授权日(2012年5月8日),只有晚于专利授权日的行政审批周期在计算PTE时才予以考虑。相应地,从2004年10月20日至2012年5月8日(包括该日),共计2759天将被扣除。并无申请人未合理尽职的天数。
上述可延长期限未触发U.S.C. §156(g)(6)(PTE不超过五年)或U.S.C. §156(c)(3)(新药批准上市后总有效专利权期限不超过十四年)的限制。
相应地,以下信息将在官方公报上公告:
专利:US8173663
专利权原始届满日:2025年3月15日
产品商品名:NESINA®(苯甲酸阿格列汀)
专利期限延长:262天
延期后专利权届满日:2025年12月2日
5、USPTO与FDA联动—第四轮:颁证及指引善后
USPTO于2016年8月25日致函申请人,并且颁发了专利保护期延长证书(Patent Term Extension Certificate),注明了基于U.S.C. §156的规定,本专利专利期限延长262天,自专利权原始届满日2025年3月15日起算。
USPTO还告知,本函同时抄送FDA,申请人可就橘皮书中专利保护期相关信息与FDA直接沟通。
6、小结
至此,USPTO与FDA就'663专利的PTE完成了多轮联动并最终精确确定了时间,与申请人的请求仅相差2天。两部门分工合作,各司其职,不仅确保了在先审批程序和数据的准确、完整和公示性,适时引入公众监督机制(美国不乏因公众对专利保护期延长不当而引发的诉讼),还确保了获批的专利延期在专利和药品渠道均能及时更新并公之于众。
五、结语
仅就《专利法》的原则性规定而言,中美专利保护期延长制度至少存在以下差异:
差异点1:
与新《专利法》第四十二条第二款“应专利权人的请求”不同,美国的PTA是USPTO在专利授权时自行计算并给予的。
差异点2:
中国没有期末放弃制度,与之类似的是分案申请制度,分案申请专利权的原始届满日与母案申请一致。但在分案申请保护期延长计算时是否会受制,尤其是分案申请的PTA与PTE能否叠加,则有待于具体细则的规定。
但在保障专利权人合法利益、弥补因行政程序冗长对专利权人实际有效专利保护期的挤占的立法本意上,中美的制度是共通的。在本文投稿过程中,恰逢国家知识产权局就《专利法实施细则修改建议(征求意见稿)》公开征求意见,其中对于专利保护期延长制度的适用对象、适用情形、请求时机、计算方式等进行了细化。好饭不怕晚,在医药体制和司法体制改革方兴未艾之时,我们希望一个科学合理、富有中国特色的专利保护期延长制度顺利落地。
本文为《美国专利保护期延长制度管窥(一)》,《美国专利保护期延长制度管窥(二)》将于近日推送,敬请期待。
注释:
[1] 本文纯属个人学术观点,所选案例也仅为研究之用。
[2] https://www.uspto.gov/patent/laws-and-regulations/patent-term-extension/patent-terms-extended-under-35-usc-156,最后访问日期2020年11月16日。