特稿 | 我国药品专利链接制度施行至今的四类声明情况回顾与分析
作者 | 许波 李晓蕾 傅晶 北京隆诺律师事务所
编辑 | 布鲁斯
第四次修订后的《专利法》自2021年6月1日实施以来,药品专利链接制度已在我国运行近一年。特别是随着“中国上市药品专利信息登记平台”(下称平台)的建立,以及《药品专利纠纷早期解决机制实施办法(试行)》(下称《实施办法》)、《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》、《药品专利纠纷早期解决机制行政裁决办法》等各项细化规则的出台,我国药品专利链接制度下的专利信息登记、专利声明、专利挑战、相关行政裁决及法院诉讼等各项程序也开始从理论探讨走向实践。然而,对比药品专利链接制度在其他国家的历史发展,我国目前尚处于起步阶段,现有规则仍有待于在实践中发现问题、解决争议、逐步完善。为促进我国药品专利纠纷早期解决机制从“1.0版本”向“2.0版本”的升级优化,同时也为观察制药企业对于这一新制度的理解与应用情况,特对药品专利纠纷早期解决机制下仿制药申请人做出的第四类声明[1]进行汇总分析,以供业界参考。
上篇
整体概述
截至今年4月
一、四类声明整体数据
1.1 统计方法
通过知产宝数据库的“药品专利”模块收集平台上公开的四类声明信息。对于同一药品存在多个上市规格,例如0.2g/片、0.1g/片的情形,现有规则要求仿制药申请人针对每个规格分别做出声明。但为便于数据统计以及有助于反映医药行业实际,本文将同一药品在不同规格下所做声明进行合并,例如针对某药品0.2g/片登记的声明内容与针对其0.1g/片所做声明内容相同者,将两规格的声明信息合并处理为针对该药品(不分规格)的声明信息。同时,以每家仿制药申请人针对每款药品(不分规格)登记的每件专利所对应的声明作为一项声明;如果该登记专利既被提出4.1类声明又被提出4.2类声明,则记为两项声明。
在此统计方式下,自2021年6月1日至2022年4月15日期间,在平台公开的四类声明按照前述“一项声明”的定义共计101项。由于一个上市药品可能被登记多件专利,同一个仿制药申请人可能做出多项声明,来自不同仿制药申请人的多项声明又可能针对同一件专利,因此上述四类声明所涉及的药品上市许可持有人、上市药品、登记专利、仿制药申请人等信息互有交叉重叠。经数据去重处理,共涉及33家药品上市许可持有人的42款已上市药品(同一药品的不同规格合并计算,下同),涵盖62件专利并涉及51家仿制药申请人。
1.2 数据校正
然而,经过仔细分析发现,目前已公开的四类声明中大约1/3存在一定问题。例如,声明所针对的专利没有在平台进行登记,或者所作声明没有给出对应的专利号,又或者声明所针对的专利早已到期,以及声明所针对的专利并非由原研药企进行登记等等。这可能是由于我国药品专利链接制度实施之初,各制药企业对声明的要求理解不同所导致,但也在一定程度上反映出现有声明规则仍需相关有权机关的进一步释明,以尽快消除分歧、统一认识、规范操作。
为避免上述“问题声明”造成统计分析的偏差,特对前述原始数据逐一进行校正,将依照《实施办法》进行专利登记和作出四类声明的情形作为校正后的数据来源,以更加客观地观察制度实施至今的情况。例如,原始数据显示的4.2类声明共涉及32款上市药品,但排除上述存在一定问题的声明情形之后,实际涉及的上市药品仅19款。因此,本文以校正后的声明相关信息为主进一步展开分析观察,而对于“问题声明”以及存在一定争议的声明情形留待后续文章中予以讨论。
1.3 不同维度下的四类声明数据分析
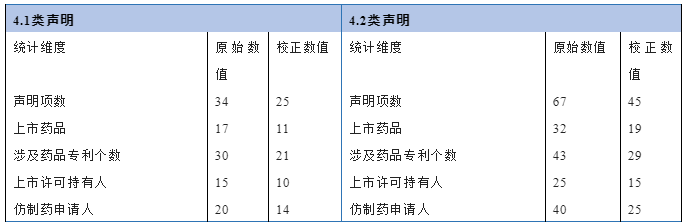
如表1所示,通过校正后的统计数据可以看出,近一年来共有14家仿制药申请人向10家药品上市许可持有人提出4.1类声明,涉及11款上市药品、21项专利;共有25家仿制药申请人向15家药品上市许可持有人提出4.2类声明,涉及19款上市药品、29项专利。假定所有的4.1类声明人都发起《实施办法》第十一条[2]意义上的专利挑战(即仿制药申请人提交四类声明且提出专利权无效宣告请求),则根据药品专利纠纷早期解决机制提出的专利无效宣告请求可达25次[3]。假定所有四类声明针对的专利都被提起是否落入保护范围的行政裁决或诉讼,则基于4.1类声明与4.2类声明的项数总和,此类案件总和可达70起[4]。需要指出的是,部分上市药品所登记的专利被多家仿制药申请人提出四类声明,其中既包括4.1类声明又包括4.2类声明,则将在不同项目下分别统计。
表1 四类声明总体情况统计
二、药品上市许可持有人与仿制药申请人
在所有药品上市许可持有人当中,阿斯利康(瑞典)有限公司可能是我国药品专利链接制度实施当下应对最为繁忙的原研药企,近一年来收到来自五家仿制药申请人的四类声明共计16项,其中针对糖尿病药物达格列净片的四类声明多达14项,另外2项涉及抗癌药奥拉帕利片。另外,诺华公司(瑞士)、住友制药(日本)、勃林格殷格翰(德国)也均收到多件四类声明,但每家原研药企涉及的上市药品仅限于1-2款(具体见表2)。上述原研药企通过在先的专利布局和当下的专利登记策略,使得每款药品均对应多项专利,这或许是四类声明数量集中的原因之一。同时,针对重磅上市药物的仿制研发间也存在激烈竞争,表现为多家仿制药企业就同一重磅药物先后提出仿制药上市申请,也是导致这些药物的四类声明集中的另一原因。
表2 四类声明中具有代表性的药品上市许可持有人
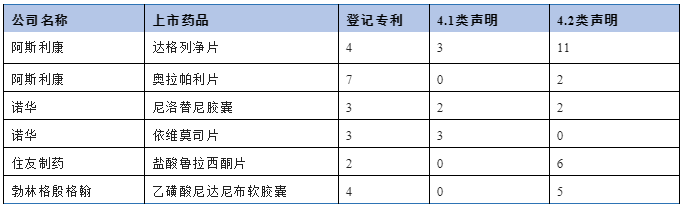
在所有仿制药申请人当中,江苏豪森药业集团有限公司(以下简称豪森公司)和齐鲁制药有限公司(以下简称齐鲁公司)提出四类声明最为积极。豪森公司对3款上市药物提出8项四类声明,不过其中仅注射用卡非佐米为4.1类声明下的专利挑战,其余两款药物则均为声明不落入保护范围的4.2类声明。齐鲁公司(包括齐鲁制药(海南)有限公司)则对6款上市药物提出四类声明,也是以4.2类声明不落入保护范围为主。虽然正大天晴药业集团股份有限公司是提出4.1类声明最多的国内药企,但这与其所仿制的原研药物之上登记的专利数量较多有一定关系。总体而言,现有声明数据也从一个侧面反映出,国内实力较强的制药企业在其仿制药项目中通常都会进行持续研发和技术改进,绕过专利壁垒成为推动仿制药顺利上市的重要选择之一。
三、受理时间及最新进展
从受理时间上看,国内第一家提出四类声明的仿制药申请人是豪森公司,其在2021年7月23日对达格列净片提出4.2类声明。紧接其后的是浙江华海药业股份有限公司对盐酸鲁拉西酮片提出4.2类声明、乐普制药科技有限公司对瑞舒伐他汀钙片提出4.2类声明、温州海鹤药业有限公司对艾地骨化醇软胶囊提出4.2类声明。目前,瑞舒伐他汀钙片声明针对的专利已到期;艾地骨化醇软胶囊声明针对的专利已被国家知识产权局宣告全部无效,不过针对该4.2类声明提起的民事诉讼仍是全国首例受理、首例宣判的药品专利链接诉讼案件[5]。具体信息见表3:
表3 早期提出四类声明的仿制药申请人
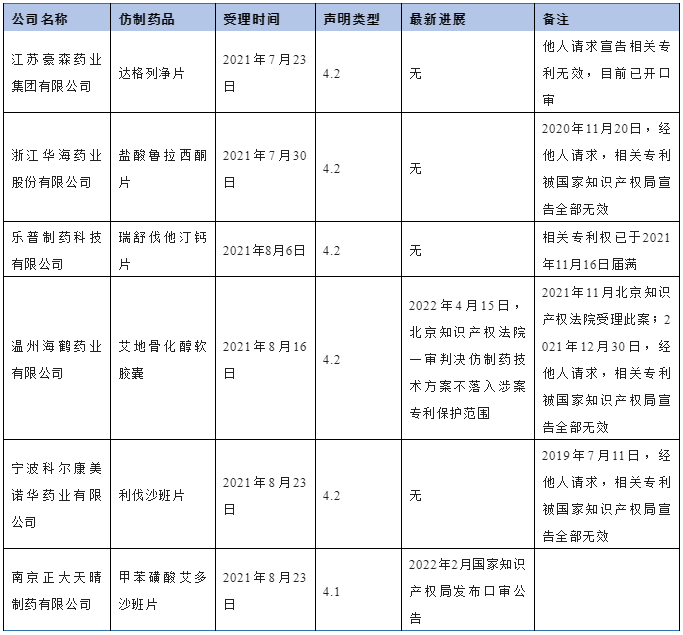
从表3亦可看出,即便是4.2类声明所针对的专利,也还存在被他人挑战的极大可能性,使得药品专利链接制度的实际施行情况更为复杂。例如,就法院首例宣判的艾地骨化醇软胶囊案例而言,在北京知识产权法院审理过程中,该案涉及的专利被国家知识产权局宣告全部无效。此时,按照《实施办法》第九条第二款第(三)项的规定,声明所针对的专利权被依法无效,相关化学仿制药注册申请在技术审评通过后将转入行政审批环节,药品专利链接诉讼的结果可能已不会影响仿制药的注册申报程序。更进一步可讨论的问题是,在专利已经被宣告全部无效的情况下,做出4.2类声明的仿制药申请人是否仍有义务举证证明其仿制药技术方案不落入专利保护范围,尤其是在很可能会涉及企业商业秘密的情况下。关于此类涉及4.2类声明和他人挑战相互交织的情形,将在后续文章中予以详细讨论。
四、小结
就确认仿制药方案是否落入专利保护范围而言,专利权人或者利害关系人既可以向国家知识产权局提起行政裁决,也可以向北京知识产权法院提起诉讼。目前,法院首个案例的一审周期在五个月左右。基于行政执法的效率原则,我们相信国家知识产权局很可能也会在近期做出全国首例药品专利链接行政裁决。至于该类行政裁决的决定将以何种方式予以公开,我们拭目以待。
中 篇
关于4.1类声明的
回顾与分析
截至今年4月
一、4.1类声明整体情况
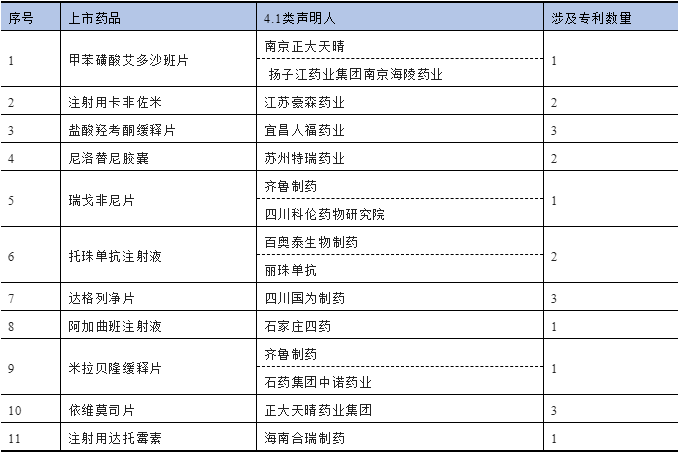
根据本文“上篇”的数据统计规则,在原统计时间段即2021年6月1日至2022年4月15日基础上,进一步补充截至2022年4月29日的声明信息,共计18款上市药品收到4.1类声明。其中,7款上市药品所对应的4.1类声明存在明显错误,因此根据校正后的数据,实际有11款上市药品收到符合规定的4.1类声明,具体见表4。明显错误的4.1类声明将在本文末尾列出。
表4 数据校正后的4.1类声明信息[6]
二、具有代表性的4.1类声明案例及进展
1. 首个4.1类声明
我国药品专利链接制度自2021年6月1日实施后,首个4.1类声明由南京正大天晴制药有限公司(简称南京正大天晴)于2021年8月23日在提出甲苯磺酸艾多沙班片(简称艾多沙班)的仿制药注册申报时而作出。对应于该4.1类声明的专利无效宣告请求已于2022年2月14日由国家知识产权局发布口头审理公告,目前尚未查到无效决定,也无请求确认是否落入保护范围的行政裁决或诉讼信息公开。
涉案的原研药物由日本第一三共株式会社研发,是四种已上市的新型口服抗凝药(NOACs)之一。该药于2011年4月率先在日本上市,2015年在美国获批上市,2018年12月正式进入中国,并于两年后纳入国家医保药品目录乙类。据报道,艾多沙班2020年全球销售额为1659亿日元(约15亿美元)[7]。国内目前仅有原研产品在售,海南先声药业有限公司首家申报该品种仿制药,南京正大天晴则为作为第二家申报的仿制药申请人提出上述4.1类声明[8]。
2. 首批专利挑战结果
江苏豪森药业集团有限公司(简称江苏豪森)于2021年9月6日就原研药企针对注射用卡非佐米(简称卡非佐米)在平台上登记的两件专利作出4.1类声明。而早在此之前,江苏豪森于2020年9月8日即对上述两项专利提出无效宣告请求,国家知识产权局于2021年5月26日对两无效案件进行了口头审理,而后江苏豪森又在我国药品专利链接制度正式实施后作出4.1类声明。在作出上述声明的当天及第三天,国家知识产权局先后作出维持专利有效的两件审查决定,由此产生4.1类声明背景下进行专利挑战的首批结果,具体如图1所示。
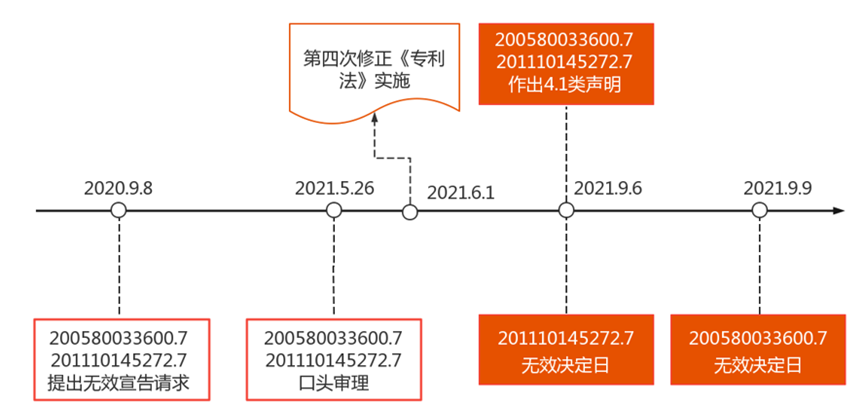
图1 卡非佐米专利挑战及四类声明的时间进程
涉案的原研药品于2012年在美国获批,是继硼替佐米后第二个被FDA批准的蛋白酶体抑制剂,用于治疗多发性骨髓瘤患者,2020年全球销售额为10.65亿美元[9]。涉案专利的专利权人目前为安进生物医药(上海)有限公司,其于2019年11月与百济神州(北京)生物科技有限公司(简称百济神州公司)达成合作,由百济神州公司负责原研卡非佐米在中国的开发和商业化。而直到2021年7月6日即江苏豪森作出4.1类声明的前两个月,原研药品才刚刚在国内获批上市[10]。基于目前的专利挑战结果,江苏豪森的卡非佐米仿制药或许要等待到2025年两件涉案专利到期后方能上市销售。
值得关注的是,本案的无效宣告请求是在第四次修正的《专利法》实施之前提出的,因此其无效宣告请求时间也在作出4.1类声明之前。而国家知识产权局公布的《专利审查指南修改草案(征求意见稿)》(简称《指南修改草案》)中规定,涉及药品专利纠纷早期解决机制的无效案件是指仿制药申请人提出第四类声明后,就声明针对的专利提出无效宣告请求的案件,并需附具仿制药注册申请受理通知书和第四类声明文件的副本等相关证明文件。因此,如果《指南修改草案》的上述规定正式通过并实施,则在作出4.1类声明之前提交的无效宣告请求将不能作为“涉及药品专利纠纷早期解决机制的无效案件”审理,进而可能无法获得审查时限、审查程序等方面的特别保障。而如果《指南修改草案》的上述规定未获通过,则仿制药申请人仍可采用类似本案的专利挑战策略,在仿制药申报注册之前就提出无效宣告请求,待作出4.1类声明时再视无效宣告请求案件进展来考虑是否补交相关证明文件。
3. 首批审结的药品专利行政裁决案件
今年4月25日,国家知识产权局发布新闻称,已审结首批共涉及三件专利的药品专利纠纷早期解决机制行政裁决案件[11]。该三件专利均涉及上市药品盐酸羟考酮缓释片,药品上市许可持有人为普渡制药公司,仿制药申请人为宜昌人福药业有限责任公司(简称宜昌人福药业)。
盐酸羟考酮属于阿片类麻醉药品,用于缓解持续的中度到重度疼痛,尤其是癌痛。除本案涉及的缓释片剂型之外,尚有注射液、胶囊等上市剂型,但缓释片具有药效长、防止滥用等优点。据报道,原研的盐酸羟考酮缓释片2015年在美国的销售额高达25亿美元 。宜昌人福药业所属的人福医药集团股份公司则是我国麻醉药龙头企业,其在积极开展新药研发和仿制药申报的同时也在不断扩展海外业务,例如2016年收购美国Epic Pharma公司100%股权 。而Epic Pharma公司当时已向FDA提出盐酸羟考酮缓释片的仿制药申请,并就原研企业在橙皮书上登记的专利发起挑战。这些海外经验或许也为宜昌人福药业在中国的仿制药申请及专利挑战打下了坚实基础。
该行政裁决请求被受理后,国家知识产权局成立了五人合议组对上述案件进行了审理,并在经过多次现场证据交换、庭前会议以及口头审理后,最终确认仿制药相关技术方案未落入上述三件专利的保护范围,前后共历时5个月24天。
值得注意的是,宜昌人福药业申报盐酸羟考酮仿制药时对上述三件专利均作出的是4.1类声明,并已对三件专利均提出无效宣告请求。国家知识产权局已于今年2月、3月分别对上述无效请求公告了口头审理,但目前尚未查到相关无效决定。从本案实践看,作出4.1类声明并进行专利挑战并不暗含着更不必然意味着仿制药相关技术方案落入相关专利的保护范围。
而同时引发的问题是,在仿制药相关技术方案未落入专利保护范围的情况下,仿制药申请人如果不能同时作出4.1类声明和4.2类声明,则该如何权衡选择?对此,可能需要综合考虑专利无效的可能性、仿制药规避专利技术方案的难度、相关药品市场竞争情况及仿制药申请人获得首仿独占期的可能性、无效或诉讼成本、举证仿制药技术方案不落入专利保护范围可能对商业秘密的影响等多方面因素。
此外,在该批行政裁决案件中,ZL201010151552.4专利所保护的技术方案实际限定了一种杂质14-羟可待因酮在药物组合物中的含量上限。根据相关报道[12],宜昌人福药业在行政裁决程序中对该专利提出了登记不当的抗辩主张,但该抗辩最终被认定不成立。尽管如此,由此引申出的亟待明确的问题是,对于权利要求实质上系保护杂质含量范围的专利,是否仍然属于可以在平台上登记的“药物组合物”专利。如果本案后续进一步产生行政诉讼,我们期待法院能对此问题给出明确观点。
4. 首个作出专利全部无效结论的审查决定
尼洛替尼胶囊的上市许可持有人为瑞士诺华公司(Novartis Pharma Schweiz AG),其就尼洛替尼胶囊在平台登记了三项专利。专利1为ZL03818728.0,涉及尼洛替尼化合物及其药用盐;专利2为ZL200680026444.6,涉及尼洛替尼单盐酸盐一水合物;专利3为ZL201080051819.0,涉及尼洛替尼单盐酸盐一水合物的制药用途。苏州特瑞药业有限公司(简称苏州特瑞药业)作为仿制药申请人,针对专利1作出3类声明,即承诺在专利1有效期届满之前所申请的尼洛替尼胶囊仿制药暂不上市;而针对专利2和专利3则作出4.1类声明,并同时请求宣告专利2和专利3全部无效。国家知识产权局于2022年2月18日对专利2作出全部无效的审查决定,成为涉及药品专利纠纷早期解决机制的无效案件中首个作出专利全部无效结论的审查决定。
值得注意的是,上述专利2的无效决定要点中指出“涉案专利保护已知化合物的具体盐型的晶体形式”,而诺华公司则将该晶体形式即权利要求1保护的尼洛替尼单盐酸盐一水合物作为“化学药品活性成分化合物专利”在平台进行登记。根据《药品专利纠纷早期解决机制实施办法(试行)》(简称《实施办法》)第五条的规定,可在平台登记的专利类型为药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利。换言之,晶型专利、制备方法专利等均不属于可登记的专利类型,《中国上市药品专利信息登记填表说明》中亦指出可登记的相关专利不包括晶型专利[13]。据此,对于专利2所保护的“一水合物”,究竟应当认定为属于药物活性成分,还是应当认定为属于晶型,进而对相关专利能否在平台上正确登记产生直接影响,该问题同样亟待明确。鉴于该专利已被宣告全部无效,国家知识产权局依照《药品专利纠纷早期解决机制行政裁决办法》第十四条的规定,已驳回专利权人提出的确认落入专利保护范围的行政裁决请求[14],因此未能对“一水合物”专利是否应当登记的问题给出意见,仍需在后续实践中等待有权机关予以明确。
另外,对于专利3的无效宣告请求,国家知识产权局也已于2022年2月10日作出审查决定,维持专利权有效。有意思的是,专利3的制药用途权利要求包括特征“尼洛替尼单盐酸盐一水合物和可药用载体分散在苹果酱中”,而无效决定指出“分散在苹果酱中”应理解为将尼洛替尼和可药用载体在制药过程中已经分散于苹果酱中,“制药过程制备获得的最终药物中应包括尼洛替尼、可药用载体和苹果酱三种成分,苹果酱作为药物的成分之一而存在;并不能理解出请求人所述的苹果酱不在药品之中、属口服使用时临时添加的成分这一含义,也无法理解出专利权人所述的尼洛替尼与苹果酱单独包装、或者在销售尼洛替尼时指示添加苹果酱的含义”。然而事实上,诺华公司上市的尼洛替尼胶囊中并不含有苹果酱,其仅是在药品说明书中指示“对于不能吞咽胶囊的患者,可以把胶囊的内容物与一茶匙的苹果酱混合在一起,混匀后应立即服用。苹果酱不能超过一茶匙,同时不能食用除了苹果酱以外的其他食物”。因此,根据药品说明书可以看出,其产品为“口服时临时添加苹果酱”或者“销售尼洛替尼时指示添加苹果酱”,而非在生产时分散在苹果酱中。对此,无效决定中认为,“本专利的制药用途涉及的产品与药品说明书涉及的产品并不具有直接和唯一对应性,商业化产品的用药方式并不能代表本专利请求保护的发明均必须采用该方式。换言之,药品说明书对尼洛替尼硬胶囊用法的说明并不能用于限定本专利权利要求中的‘分散’行为发生的时机”。由此可见,虽然专利3被维持有效,但如果根据上述无效决定对权利要求的解释,专利3的保护范围是否还能覆盖获批上市药品的相应技术方案,就成为一个值得关注和进一步探讨的问题。原因就在于,无法覆盖获批上市药品技术方案的专利,是不应该在平台上登记的。由此也可以看出,在药品专利链接制度的实际运行中,各个程序之间总会在不经意间呈现出千丝万缕的联系,从而对此类纠纷的有效、妥善处理提出了更高要求。
三、小结
虽然《实施办法》中还对首仿化学药给予市场独占期的激励,但从目前的制度运行实际看,其激励作用似乎并不明显,这也体现在4.1类声明的数量远低于4.2类声明及其他类型声明,与4.1类声明相关的案件数量也低于预期。围绕尼洛替尼胶囊的专利挑战虽然向着该目标有所前进,但至少目前仍需等待其化合物专利期限届满,相关仿制药企业能否获得市场独占期仍未可知。近日,米拉贝隆缓释片在平台登记的专利被宣告全部无效,但无效请求人却并非作出4.1类声明的齐鲁制药有限公司或者石药集团中诺药业(石家庄)有限公司,而是在上述4.1类声明之前就已提起无效宣告请求的南京正大天晴。截至目前,能够符合《实施办法》第十一条所定义的“挑战专利成功”的实际案例尚未出现,究竟哪家制药企业能够获得以及能在何时获得首个市场独占期,仍需拭目以待。
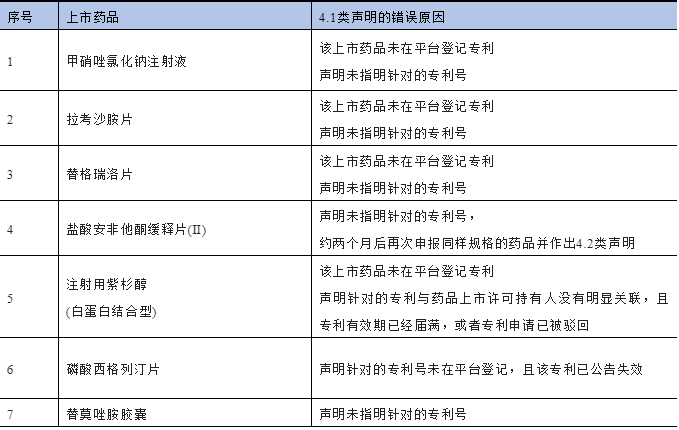
附:存在明显错误的4.1类声明
下 篇
关于4.2类声明的
回顾与分析
截至今年9月
根据本文“上篇”的数据统计规则,在原统计时间段即2021年6月1日至2022年4月15日基础上,进一步补充截至2022年9月14日的声明信息,共计47款上市药品收到4.2类声明111项,涉及66家仿制药申请人。
通过对这些4.2类声明的逐一分析,观察到表现截然不同的仿制药申请人:一部分仿制药申请人对药品专利链接制度秉持积极学习和勇于实践的态度,尝试利用药品专利链接的现有规则切实维护自身利益,所作出的4.2类声明在某种程度上反映出对原研药企所登记专利的异议或反制,引发如何规范中国上市药品专利信息登记平台(下称“平台”)的专利登记行为、防止登记不当的思考;而一部分仿制药申请人似乎仍对药品专利链接制度的理解不够充分,以致作出的4.2类声明存在明显错误。通过对平台登记专利进行分析后发现,由于平台专利登记规则尚不明确、各企业对声明存在不同认识等原因,导致声明混乱的现象普遍存在,其中4.2类声明所对应的情形最为典型和全面,由此,本文在对4.2类声明回顾分析的同时兼对平台专利登记及声明规则进行讨论。
一、4.2类声明的几种特殊情形
1. 针对“化合物专利”作出4.2类声明
根据现行化学药品注册分类规定,仿制药品具有与原研药品相同的活性成份、剂型、规格、适应症、给药途径和用法用量[15]。基于该分类规定,仿制药品应与原研药品具有相同的活性成分,如果平台登记的化合物专利保护范围覆盖原研药品的活性成分,那么也理应覆盖仿制药品的活性成分。因此通常情况下,化学仿制药对药物活性成分化合物专利较难规避。然而在统计中发现,存在多个仿制药申请人针对化合物专利作出4.2类声明的情况,个别4.2类声明甚至备注“API与该专利不同”(API即Active Pharmaceutical Ingredients,原料药)。经核对,此类声明大多存在错误。但在这其中,达格列净片(详见第二部分)与尼洛替尼胶囊的化合物专利4.2类声明颇为值得关注和研究,可以作为例外情形予以考量。
如本文“中篇”对尼洛替尼胶囊的4.1类声明介绍中提及,该上市药品在平台登记的专利2涉及尼洛替尼单盐酸盐一水合物,其无效决定要点中指出“涉案专利保护已知化合物的具体盐型的晶体形式”。作为一种盐的晶体形式,一水合物专利在平台登记规则中究竟应视为化合物专利还是晶型专利,却因专利2被宣告全部无效而未在相关案件中予以明确。
而在专利2被宣告全部无效之前,已有仿制药企业针对该一水合物专利作出了不落入保护范围的4.2类声明。如果该声明是仿制药企业的正确意思表示,则4.2类声明的作出依据应当在于API的水分子不同(因为对API其他结构的改变,即便是改变盐型,也会使得该药品需以改良型新药而非仿制药作为申报类型),例如仿制药采用了尼洛替尼单盐酸盐的无水物,或其半水合物,或二水合物,等等。鉴于尼洛替尼单盐酸盐一水合物如其无效决定所述是一种“晶体形式”,对水合物的规避本质上仍是对API的晶型规避。
根据《药品专利纠纷早期解决机制实施办法(试行)》(简称《实施办法》)第五条的规定,可在平台登记的专利类型为药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利。该条对于能够在平台上登记的药物专利类型作了封闭式规定,换言之,晶型专利不属于可登记的专利类型。《中国上市药品专利信息登记填表说明》中亦明确指出可登记的相关专利不包括晶型专利[16]。就此而言,将水合物专利视为晶型专利而不予登记更为合理。如将其视为原研药品的化合物专利,将出现“仿制药品采用与原研药品相同的活性成分、却不落入原研化合物专利”这一看似悖论的主张。而其背后所反映出的问题是平台登记规则对“化合物专利”和“晶型专利”的界定不明确,由此留出了解释和试探的空间。尼洛替尼胶囊的4.2类声明实质引发了对平台登记规则的再思考,随着未来对平台专利登记行为的进一步规范,以及声明错误的进一步降低,对化合物专利作出4.2类声明的情形应当会越来越少。
2. 针对“医药用途专利”作出的4.2类声明
根据现行化学药品注册分类规定,仿制药品具有与原研药品相同的适应症。在此定义下,如果仿制药上市申请人仍然能够提出不落入原研医药用途专利保护范围的4.2类声明,一种可能的合理情形是仿制药品进行了“缩减标签”,即仿制药的药品说明书相比原研药的药品说明书删减了该医药用途专利所涵盖的适应症,通过缩小适应症范围来规避医药用途专利。在药品专利纠纷早期解决机制的行政裁决(下称药品专利纠纷行政裁决)实务中,原则上以药品说明书的“适应症”部分为基础确定仿制药的医药用途[17],从而使得仿制药申请人能够以放弃部分适应症的方式进行药品申报并以此作为4.2类声明的声明依据。
然而,除上述“缩减标签”的情形之外,实务中还观察到另外两种与平台专利登记规则相关的4.2类声明:
(1)平台所登记专利不满足《实施办法》第四条“医药用途专利权与获批上市药品说明书的适应症或者功能主治应当一致”的规定。例如托伐普坦片的上市许可持有人在平台登记专利ZL200480000735.9的医药用途保护范围为“在制备用于治疗纽约心脏协会分类IV类重度心力衰竭的药物中的应用”;根据该专利说明书的记载,纽约心脏协会分类包括重度I型、II型、III型、IV型心力衰竭,可见该医药用途专利所保护的IV类重度心力衰竭是心力衰竭的一种细分类型。而托伐普坦片的药品说明书记载适应症为:1.低钠血症;2心力衰竭引起的体液潴留,该两项适应症与“纽约心脏协会分类IV类重度心力衰竭”均不一致。此情形下即便仿制药的药品说明书与原研药完全相同,但因原研药的药品说明书适应症与医药专利保护范围不一致,仿制药的适应症有极大可能不落入专利保护范围。在此情形下,4.2类声明会引发出对该专利登记是否恰当的异议。
(2)原研医药用途专利是保护特定晶型的制药用途。例如马来酸奈拉替尼片的药品专利纠纷行政裁决[18]中,仿制药申请人对平台登记的医药用途专利作出4.2类声明,裁决要点中指出该专利的权利要求5-6作为晶型的制药用途权利要求,属于《<药品专利纠纷早期解决机制实施办法(试行)>政策解读》所排除的“晶型的专利”的范畴。并且,对于请求人提出“目前已有不少专利权人在专利信息平台上登记了晶型的用途权利要求”的现状,国家知识产权局回应其“系相关专利权人对于实施办法及其政策解读的理解不当造成的”。由此,专利权人或利害关系人就此类4.2类声明提起的裁决请求将被直接驳回,不进行是否落入专利保护范围的实体审理。由此,该案的4.2类声明起到了对抗专利不当登记的作用,其虽非专利链接制度对4.2类声明的设定本意,却或许成为目前提出专利登记异议并获得有关部门支持的最为有效手段。
3. 针对已被宣告无效的专利作出4.2类声明
药品专利链接实务中存在一类特定情形,即平台登记专利已被国家知识产权局宣告无效,而仿制药申请人仍需进行专利声明。据不完全统计,至少9个上市药品共计13项专利被宣告无效后仍在平台登记,约30余家仿制药企业对此类专利提出各类声明约60项,详细统计信息已在本团队另外文章中予以介绍。对于已被宣告无效的专利如何进行声明,目前尚无明确规范。对于实践中出现的作出4.2类声明的情形,除仿制药技术方案客观上不落入专利保护范围之外,还可能包括着另一层含义,即被宣告无效的专利在法律上视为自始无效,仿制药技术方案不会落入一个自始不存在的“专利”保护范围之中。
4. 针对已届满失效的专利作出4.2类声明
针对专利期限已经届满失效的专利,实践中也有仿制药申请人做出4.2类声明的情况。例如,某药片在平台登记的信息中明确记载其专利保护期届满日为2021年11月16日,但仿制药申请人在2021年12月9日提交药品上市许可申请时仍然对该专利作出4.2类声明,然而此时专利权届满失效已逾三周。
之所以出现这种情况,一方面可以归因于原研药品的上市许可持有人在缺乏监管的情况下未及时清理失效专利,例如前述专利至今(届满时效一年后)仍在平台上登记;另一方面,仿制药申请人亦未核对专利登记信息和法律状态,以致作出错误声明,甚至有可能在技术特征的实质比对、4.2类声明函的准备和通知、向原研企业提供仿制药相关技术资料等方面进行本无必要的工作。
5. 其他存在明显错误/存疑的4.2类声明
在本文“中篇”对4.1类声明进行整体情况介绍时,已提到过7款上市药品的4.1类声明都存在明显错误。该问题在4.2类声明中更加突出,统计数据中超过40%的4.2类声明都存在明显错误或因现有规则不明确而存疑,且错误声明针对的上市药品多达19款。具体数据以及错误原因已在本团队其他文章中予以详细介绍,本文仅对一些典型情形简要列举如下:
(1)上市药品在平台登记专利,仿制药申请人作出4.2类声明时未指明具体专利号及权利要求。例如,马来酸阿法替尼片在平台登记2件专利共计4组不同类型的权利要求,仿制药申请人进行4.2类声明时既未指明具体针对那件专利,也未指明针对哪组权利要求。
(2)上市药品未在平台登记专利,仿制药申请人作出4.2类声明时未指明具体专利号及权利要求。例如,氧\氧(气态)\氧(液态)等系列氧制品均未在平台登记任何专利,但从2021年12月至2022年8月期间,有7家国内制药企业陆续对该类制品提出4.2类声明,部分声明还填写了药品上市许可持有人,但均未填写登记的专利号。
(3)上市药品未在平台登记专利,仿制药申请人作出4.2类声明时指明的专利信息是其自行收集得到。例如,胞磷胆碱钠注射液的原研药品未进入中国,根据《实施办法》第四条的规定不能在平台登记专利。某仿制药申请人自行收集3件专利信息并分别作出4.2类声明。经核实,这3件专利分别为另外三家国内制药企业所申请,且与原研药品的权利人均无关联。
(4)上市药品未在平台登记原研专利,其他制药企业以上市许可持有人的身份登记专利,仿制药申请人针对其他制药企业登记的专利作出4.2类声明。例如,布洛芬混悬液原研药品的上市许可持有人为上海强生制药有限公司,其未在平台登记任何专利。A公司的布洛芬混悬液已获批上市,并以上市许可持有人的名义在平台登记一件该药品相关专利。B公司在仿制药申报时填写A公司为上市许可持有人并作出4.2类声明,而其他仿制药申请人则均以上海强生制药有限公司为上市许可持有人并作出1类声明。对于此类情形,《实施办法》虽并未明确规定上市药品许可持有人只能是原研药品的许可持有人,但从药品专利链接制度本意出发,以及与其他国家的类似制度比较而言,专利登记似乎应限于原研药品,对此仍有待进一步规范,具体见本团队其他文章的分析。
综上,从4.2类声明的种种情形可以管窥我国药品专利链接制度的现阶段运行实况,从中可以体现出该制度在国内仍处于初步落地实施阶段,部分上市药品存在专利登记混乱、专利声明随意等问题,一些特定情形下的专利登记和声明规则仍有待进一步完善。同时,现有《实施办法》搭建的规则体系及其具体适用仍需在制药行业进一步宣传普及。
二、4.2类声明的典型药物-达格列净
达格列净是全球首个获批上市的SGLT2抑制剂,用于治疗2型糖尿病及心衰,2020年销量已达19.6亿美元[19]。达格列净片的上市许可持有人为阿斯利康(瑞典)有限公司(下称阿斯利康公司),其在平台登记4件专利信息,登记类型涉及活性成分化合物、药物组合物及医药用途。目前已有9家仿制药申请人就上述登记专利作出共计20项4.2类声明,以及1家仿制药申请人作出3项4.1类声明。此外,还有其他多家仿制药申请人提出了药品专利链接制度之外的专利无效挑战。假定每项4类声明都引发行政裁决或诉讼,则阿斯利康公司仅就达格列净1个上市药品需要应对的行政裁决、诉讼、专利无效纠纷理论上将高达三四十起。可以说,达格列净是目前原研药品与仿制药品的专利战中战火最为密集的上市药品。
表5 达格列净专利登记、专利声明及专利无效请求信息
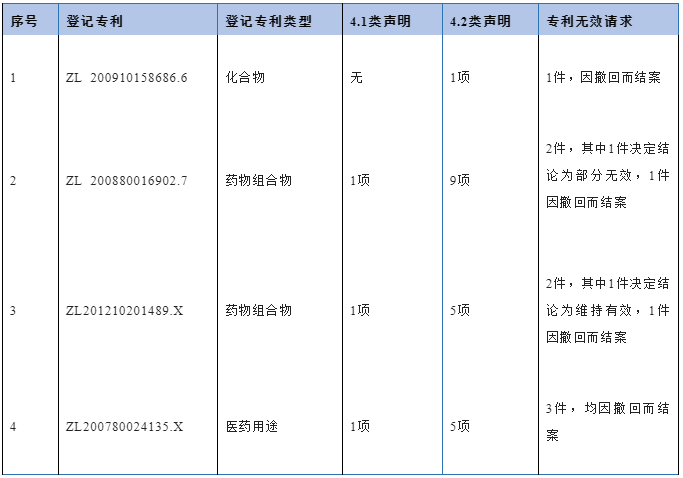
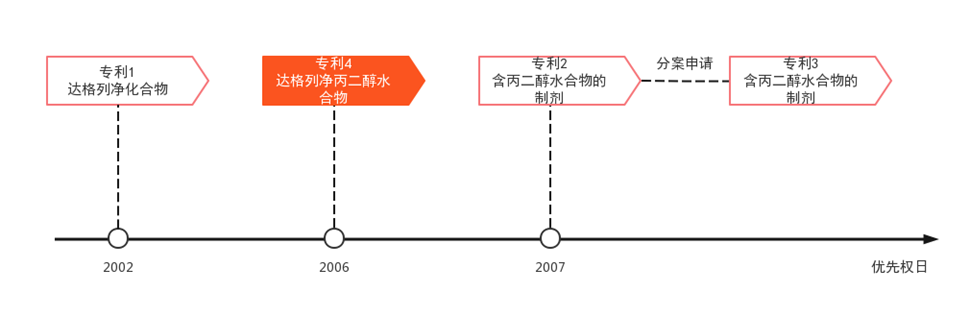
阿斯利康公司围绕达格列净进行了一系列专利布局,其中保护中间体、晶型的多件专利在平台登记信息中并未完全体现,但业内亦有关注[20]。仅就平台登记信息而言,表5所示专利1为达格列净的化合物专利;专利4实际为达格列净丙二醇一水合物的晶型专利,平台登记的权利要求9保护该溶剂化物晶型的制药用途;专利2保护含有达格列净丙二醇水合物的药物制剂;专利3作为专利2的分案,同样保护含有该溶剂化物的药物制剂,其关系图如下:
对于专利1,目前平台上共有8家仿制药申请人作出3类声明,仅1家仿制药申请人作出4.2类声明。如第一部分第1点所述,化学仿制药通常难以规避药物活性成分化合物专利,因而不排除该声明存在错误的可能。此外,原研上市的达格列净片为达格列净丙二醇一水合物即溶剂化物,而专利1所保护的是达格列净或其药学上可接受的盐或其立体异构体,两者之间的不一致也可能是仿制药申请人作出4.2类声明的考虑因素。目前尚未查到阿斯利康公司针对该4.2类声明提出行政裁决或者法院诉讼的相关信息。由于专利1在2023年5月即将到期,仿制药上市申请的审批程序届时可能尚未结束,3类声明或者4.2类声明的不同选择对于药品审批而言差异不会太大。
对于专利4,其权利要求1保护“具有式Ia的结晶结构”,权利要求9保护“权利要求1所述的结晶结构”的制药用途。虽然阿斯利康公司仅仅在平台登记了权利要求9,但如前述第一部分第2点马来酸奈拉替尼片案例所指出,该权利要求9本质上仍然属于晶型专利。虽然该专利4历经3次无效请求均以结案告终,该专利目前处于有效状态,但按照国家知识产权局当前的行政裁决标准,该专利并不应被纳入现行药品专利链接制度中,以专利4为基础提起的药品专利纠纷行政裁决请求被驳回的可能性较高。
或许受上述因素影响,阿斯利康公司一方面在应对达格列净专利无效请求方面取得较为成功的“防守”结果,另一方面并未在药品专利链接的行政裁决或诉讼中表现出特别主动的“出击”,目前仅观察到其针对专利3、专利4分别提起一件行政裁决请求且已主动撤回。但是,考虑到达格列净严密的专利布局,仿制药的上市销售仍存在重重障碍,有报道指出阿斯利康公司已对最早获批上市的仿制药展开维权行动[21]。达格列净片的专利无效、专利链接、专利侵权三重攻守战的序幕已徐徐展开,随着更多仿制药申请人提交上市许可申请,这场战争或许还将持续,甚至愈加激烈。
注释
[1]根据《药品专利纠纷早期解决机制实施办法(试行)》第六条的规定,化学仿制药申请人提交药品上市许可申请时,应当对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明。声明分为四类,其中第四类声明是“中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围”。
[2]该条规定:挑战专利成功是指化学仿制药申请人提交四类声明,且根据其提出的宣告专利权无效请求,相关专利权被宣告无效,因而使仿制药可获批上市。
[3]共有21件专利被提出4.1类声明,其中有4件专利是两家化学仿制药申请人先后提出4.1类声明,所以共计25次专利无效宣告请求。
[4]为统计方便,本文将仅药品规格不同的行政裁决或诉讼合并为一起案件计算。实务中则需针对不同规格药品分别提出声明,从而分别提起行政裁决或诉讼,因此实际案件量可能超过70起。
[5]首例受理的报道见https://bjzcfy.chinacourt.gov.cn/article/detail/2021/11/id/6365442.shtml,首例宣判的报道见https://www.chinacourt.org/article/detail/2022/04/id/6636965.shtml。
[6]为简洁起见,4.1类声明人的企业名称进行略写。表4的序号以4.1类声明受理时间进行排序,同一上市药品有多个4.1类声明导致多个受理时间的,以最早受理时间为准。
[7]参见https://xueqiu.com/9473342709/195496726。
[8]参见https://www.163.com/dy/article/GBMTFTCU05349C3I.html
[9]参见https://www.cn-healthcare.com/articlewm/20210712/content-1242129.html
[10]参见https://www.cn-healthcare.com/articlewm/20210908/content-1262052.html
[11]参见http://www.cnipa.gov.cn/art/2022/4/25/art_53_175126.html
[12]参见http://www.cnipa.gov.cn/art/2022/4/25/art_53_175126.html
[13]参见https://wenku.baidu.com/view/021df43daf51f01dc281e53a580216fc710a530e.html
[14]参见http://news.sohu.com/a/542149196_121124543
[15]国家药监局关于发布化学药品注册分类及申报资料要求的通告(2020年第44号),https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20200630180301525.html?type=pc
[16]https://www.cde.org.cn/main/news/viewInfoCommon/0885e0d81e5cf9ba247efa3291410be2
[17]药品专利链接专题稿(三)|药品专利纠纷行政裁决案件中仿制药用途技术方案的确定,吴通义,IPRdaily,https://mp.weixin.qq.com/s/6FQij1uOdLEr1UtP00m1xw
[18] (2022)国知药裁0015号
[19]http://med.china.com.cn/content/pid/294569/tid/1026
[20]一触即发!达格列净的国内市场将会如何? kevindy,药渡,https://mp.weixin.qq.com/s/a9fdI1lBPic7b0BEz7rf8w;仿制药侵权实例分析,郭晶涛,药渡,https://mp.weixin.qq.com/s/dHG2rnyag0Efnnzxr5DJrw
[21]阿斯利康出手了,四川国为、福元医药卷入达格列净仿制侵权纠纷,IvesDuran,知产力MED+,https://mp.weixin.qq.com/s/JaFDZqBSvIJpEf4q1jAw9w
(封面来源 | 网络)



















