“芬戈莫德”专利无效案反转,对诺华有什么影响?
本文系结合公开资料撰写,如有错漏之处,欢迎联系作者批评指正。
作者 | IvesDuran
编辑 | 墨客
在现代医学中,药物治疗、手术治疗、介入治疗和物理治疗都是治疗手段,其中的药物治疗是最常见和主要的手段之一,因而药品的需求和市场极为广泛。通过专利权和一系列药品相关行政程序的利用来争夺市场,是药品行业竞争中的常见操作。
6月21日,诺华(Novatris)与东阳光(HEC)“芬戈莫德”专利无效案迎来阶段性反转裁决。美联邦巡回上诉法院(CAFC)做出重审裁定,推翻了今年1月份地方法院做出的审判结果,认定诺华公司US 9,187,405专利(下称405号专利)无效。
诺华表示,计划提交请愿书,进一步审查这一决定。
其实此前诺华已经持此专利起诉了东阳光侵权,这件若被专利无效起码可解东阳光侵权困局,但显然这件专利无效关乎诺华更多商业利益,而历史上精彩纷呈的药企间商业攻防故事告诉我们,两家药企针对这一药物的动作,可能才刚刚拉开序幕。
年销售额近30亿美元,市场规模230亿美元
诺华罕见病用药拳头产品

公开资料显示,多发性硬化症(MS)是全球除外伤以外最常见的青壮年致残性神经系统疾病之一,患者常会出现肌无力、视力急剧下降等症状,尚无法完全治愈。目前,全球大约有超过230万例多发性硬化症患者,市场规模达230亿美元。
(来源:方舟健客)
2010年9月,由诺华和日本三菱制药共同研发的药品——芬戈莫德(Fingolimod,商品名Gilenya,中文译名“捷灵亚”)在美获批上市。这是全球首个口服给药治疗多发性硬化症的药物。
(来源:insight医药数据库)
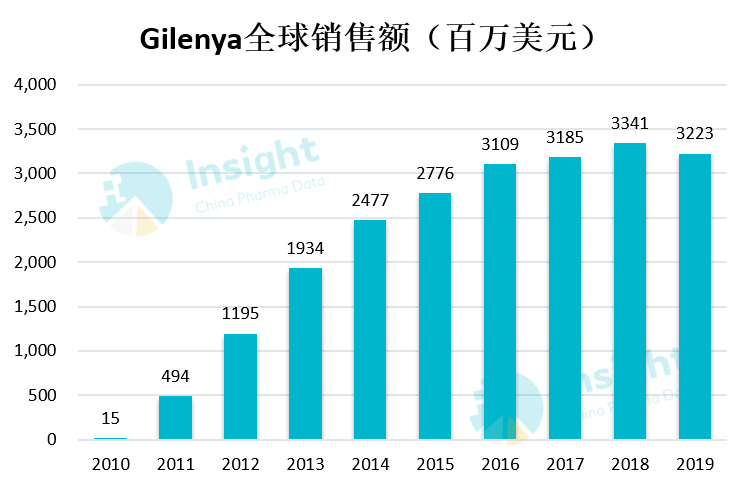
芬戈莫德上市之后,销售额逐年增长。2016年之后,虽然受到赛诺菲、罗氏、拜尔制药等同行竞争和专利到期的影响,销售额有所下滑,但它依然是是诺华其神经科学领域最畅销的产品之一。2021年,芬戈莫德给诺华带来了近28亿美元的收入。
目前,我国有超过3万名多发性硬化症患者。2018年5月,多发性硬化症被列入被纳入我国《第一批罕见病目录》。
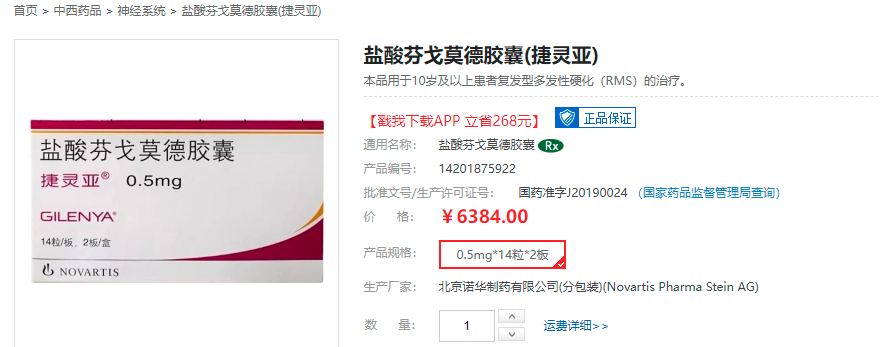
2019年7月,芬戈莫德在国内获批上市,用来治疗10岁及以上患者的复发型多发性硬化。这是国内唯一一款有儿童适应证的多发性硬化疾病DMT(疾病修正治疗)药物。
据报道,芬戈莫德在国内上市之初,一盒2板的价格为10500元人民币。如果按照患者每天口服1粒的方式计算,这款药物每月(28天计)患者要承担的费用超过万元。
目前,芬戈莫德的医保价格为228元/粒,一盒定价6300多元。尽管已经被纳入医保,但芬戈莫德的药价对于许多患者家庭来说仍然非常昂贵。
诺华芬戈莫德药品专利信息简述

(Fingolimod,source:FDA,The Orange Book)
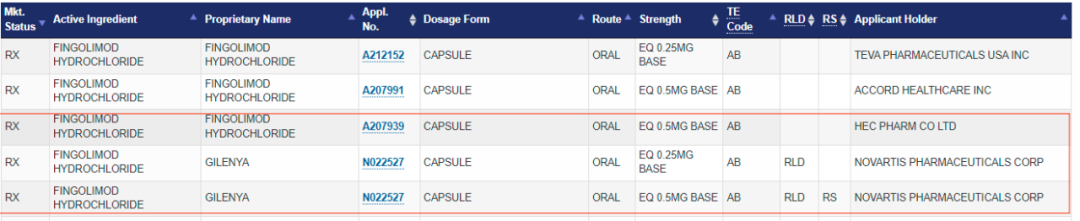
美国橙皮书公开信息显示,诺华2010年在美上市的盐酸芬戈莫德胶囊的规格为0.5mg。

(US5,604,229A,source:Google Patent)
针对这一规格,诺华在上市之初申报的专利仅有一件化合物专利US5,604,229(下称229号专利)。229号专利的优先权日为1992年10月20日,于2019年2月28日到期。基于35 USC§156法案,这件专利取得了为期5年的专利期延长(PTE)。
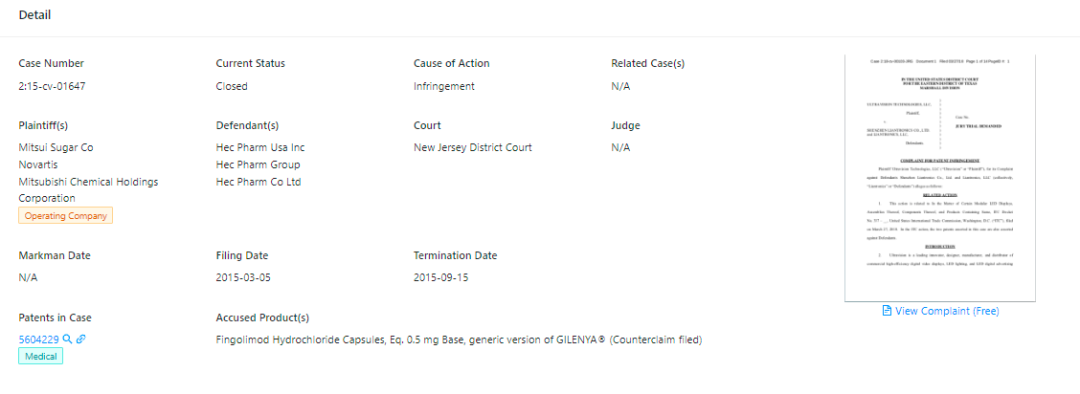
(Case Number: 2:15-cv-01647, source: Unified Patents)
2015年3月,针对229号专利,诺华曾以专利侵权为由,将东阳光制药(HEC Pharm)告上美国新泽西州法院,这起诉讼在同年9月就宣告终结。而后,诺华曾与包括Ezra、Actavis、Aurobindo Pharma等企业针对229号专利展开侵权诉讼。

(详见 :17-2284Opinion.12-7-2018, NOVARTIS AG v. EZRA VENTURES LLC)
2018年12月7日,美联邦巡回上诉法院驳回了医疗技术公司Ezra关于229号专利无效的提议,将其专利维持至 2019 年。

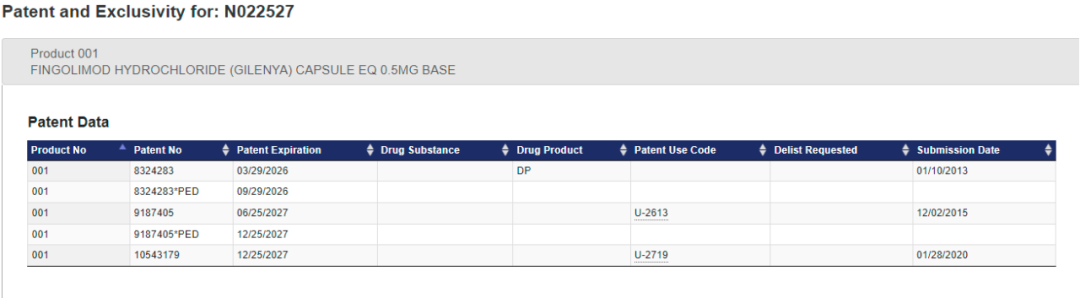
(0.5mg规格芬戈莫德胶囊专利信息:US8,324,283/9,187,405/10,543,179)
目前,橙皮书公开的诺华0.5mg规格的芬戈莫德专利信息如上。
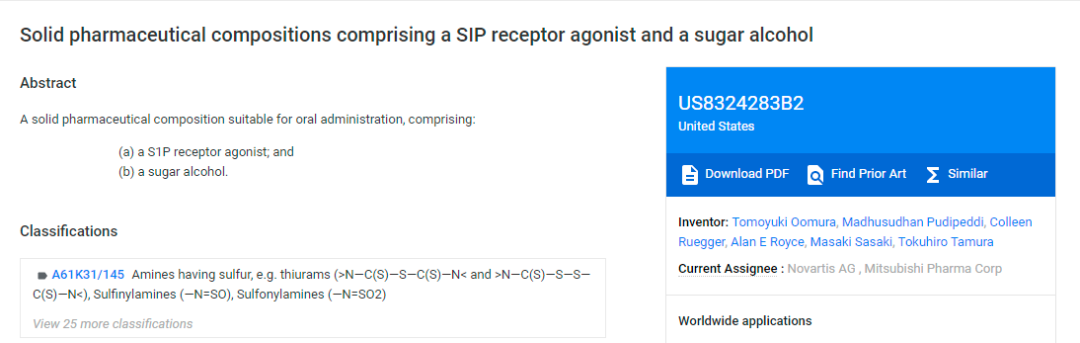
(US8,324,83B2 source: Google Patent)
虽然诺华“保住”了核心化合物专利的完整专利期限,但针对组合物专利US8,324,283(下称283号专利),诺华在诉讼中“失利”。2017年,在诺华与Torrent等仿制药企的专利诉讼中,联邦法院维持了美国专利审判和上诉委员会(PTAB)的裁定,认定诺华283号专利缺乏创造性。
(详见:Final decision-112-TORRENT PHARMACEUTICALS LIMITED and APOTEX, INC. AND MYLAN PHARMACEUTICALS INC.v. NOVARTIS AG AND MITSUBISHI PHARMA CORP.)

(0.25mg规格芬戈莫德胶囊,source:FDA,The Orange Book)
值得一提的是,针对0.5mg规格的芬戈莫德胶囊,诺华的US10,543,179(下称179专利)在橙皮书的申报日期为2020年1月28日。而在这件专利获得优先权之后,几乎同一时间,2018年5月11日,0.25mg规格的芬戈莫德胶囊在美获批上市。
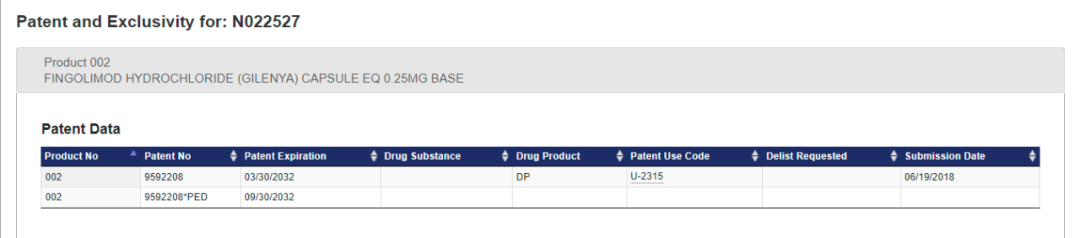
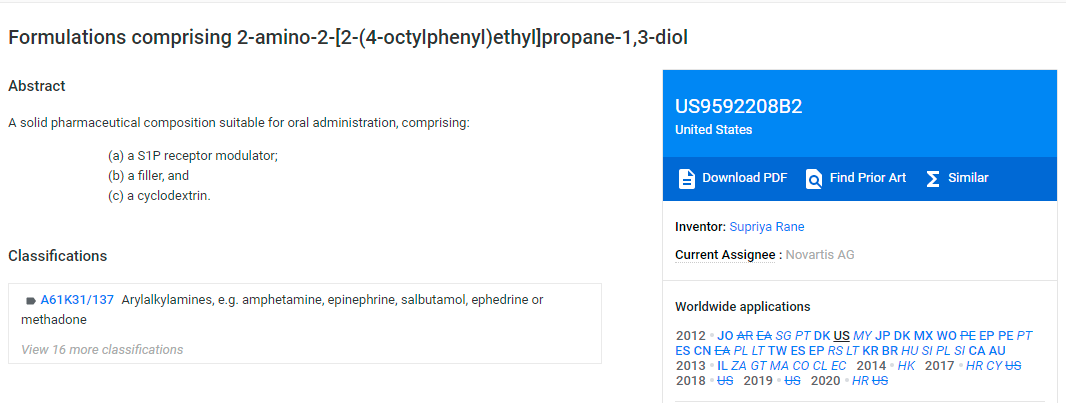
(US9,592,208B2,source: Google Patent)
该药物项下公开的专利为US9,592,208,是一件制剂专利,将于2032年3月30日到期。目前尚无相关专利无效信息公开。
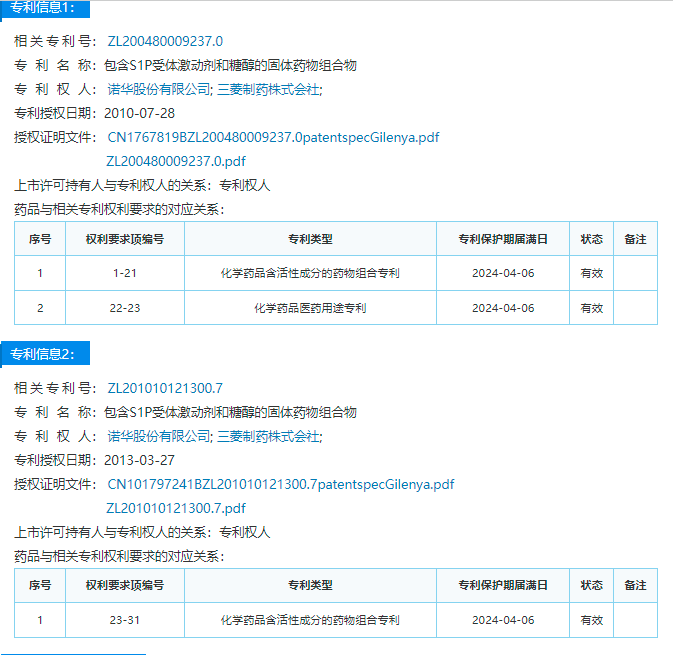
目光转向国内,知产宝药品专利数据库显示,针对盐酸芬戈莫德胶囊0.5mg规格,诺华公开了两件中国专利,均为组合物专利,专利保护期将于2024年4月届满。但目前尚无与之相关的专利挑战信息公开。

(US9,187,405B2, source: Google Patent)
不满足充分公开原则,芬戈莫德给药方法专利案反转

最新的裁决中,涉诉的405号专利是一件新用途专利,将于2027年到期,涵盖了芬戈莫德的给药方案。
围绕405号专利,诺华曾与包括Teva、Sun在内的多家仿制药企展开专利侵权与无效纠纷。后来,多家仿制药企与诺华达成和解协议,承诺在特定情况下在给药方案专利到期之前或更早的约定日期推出 Gilenya 的通用版本,只有东阳光药业坚持对诺华发起专利挑战。
最新裁定显示,诺华405专利被无效的理由是,专利文件不满足“充分描述”原则。
A method for reducing or preventing or alleviating relapses in Relapsing-Remitting multiple sclerosis in a subject in need thereof, comprising orally administering to said subject 2-amino-2-[2-(4-octylphenyl)ethyl]propane-1,3-diol, in free form or in a pharmaceutically acceptable salt form, at a daily dosage of 0.5 mg, absent an immediately preceding loading dose regimen.
本案中,如下划线所示,405号专利权利要求1中提到“治疗中不需要再每日0.5剂量开始之前,给病人一个负荷剂量”。但关于“负荷剂量”这一否定式限定(negative claim limitation),并没有出现在专利说明书中。
权利要求中披露,但在说明书中对此保持“沉默”,此种表述方法是否能够被视为该专利技术已得到充分描述(written description)?
在此之前,今年1月份做出的裁决中,联邦巡回上诉法院合议庭以2:1的票数比,驳回了东阳光药业对于专利缺乏完善的书面描述的论点。
支持“沉默应当认定为充分的描述”这一观点的法官认为,就涉案专利而言,同业人员能够结合说明书的描述,得出与权利要求1表述一致的“不需要负荷剂量”的结论。
6月21日公开的裁决中,局势发生反转——发明人必须提供对专利的内容的精确定义,以表明他们拥有该发明专利权。
合议庭的多数观点认为,“沉默”意味着在描述中没有提及某个特征,这通常不能支持否定式限定,除非专利所有者表明该领域的专业人士通常能够理解应该排除该特定特征。
法官引用了专家证词认为,没有证据表明熟练的技术人员会理解关于负荷剂量的沉默以必然排除负荷剂量。事实上,所有专家都同意,有时会给多发性硬化症患者服用负荷剂量。
在此之前,反对维持专利有效性的法官还提到,如果将“沉默”视为对专利内容的充分的描述,会降低“充分描述”的判断标准。
(详见:NOVARTIS PHARMACEUTICALS v. ACCORD HEALTHCARE INC. Field 6.21.2022)
实践中,充分描述的判断是药品专利纠纷案中常见的议题之一。多家创新药企曾因为不满足“充分描述”的判断标准,导致药品专利权被无效。
2019年,美国法院审理的诺瓦vs 瑞迪实验室专利纠纷案,涉及两件药品专利US6,926,907、8,557,285,瑞迪实验室以“未能满足充分描述”等理由,申请裁判涉案专利无效。
地方法院与联邦上诉法院对此持有相反观点。上诉法院认为,说明书必须包含足以表明该发明人拥有该发明的书面描述。“书面说明要求的目的比仅仅解释如何‘制造和使用发明’更广泛……书面说明要求的关键是说明书是否告知公众要求保护的发明的边界和范围,并显示发明人拥有要求保护的发明的所有方面。”法院在裁文中说道。
上诉法院的结论是,说明书在对权利要求中提到的必要功效提供充分的书面描述方面存在 "致命的缺陷",并推翻了地区法院关于被告没有证明'907和285号专利因不符合35 U.S.C. § 112的要求而无效的裁定。
(详见:Nuvo Pharmaceuticals (Ireland) Designated Activity Co. v. Dr. Reddy's Laboratories Inc. (Fed. Cir. 2019),17-2473.Opinion.5-15-2019.pdf)
再比如,2021年朱诺医疗vs凯特公司CAR-T专利侵权纠纷案,前者归属于百时美施贵宝,后者则是吉利德旗下公司。两家公司围绕一款名为Yescarta(商品名:奕凯达,阿基仑赛注射液)的CAR-T药物对簿公堂。这是一款细胞治疗类药品,用来治疗某些类型的大B细胞淋巴瘤,这款药去年为吉利德带来了近 7 亿美元的收入。
地方法院审理阶段,朱诺医疗获赔12亿美元,但到了巡回上诉法院,涉案专利US7,446,190的4项权利要求均因不能满足“充分描述”的要求被无效。
近日,朱诺医疗向美最高院提交请愿书,要求其审查巡回上诉法院在2021年8月做出的这项裁决。朱诺医疗在请愿书中提问到:
“某一专利是否满足‘充分描述’应当通过‘能够让任何本领域技术人员能够制造和使用相同的完整、清晰、简洁和准确的术语’这一法定标准来衡量,抑或是可以考虑根据联邦巡回法院的测试进行评估,该测试用来验证发明的书面描述能够覆盖要求保护的发明的全部范围”,包括每个组件的所有“已知和未知”变化 ?”

(Source: Juno Petition Asks SCOTUS to Clarify Written Description Standard,IPwatchdog)
朱诺医疗与凯特公司的专利诉讼后续进展,知产力MED+将持续跟踪报道。
0.5mg规格药品专利行将到期,突破179号专利或成首仿关键

回到本案,405号专利是否会因为公开不充分被无效,还有待美国最高法院的最终裁决。针对 HEC 的永久禁令仍然有效。诺华认为,HEC 和其他 ANDA 申请者目前不允许推出 Gilenya 的通用版本。
(HEC PHARM, 0.5mg Fingolimod, source: The Orange Book)
针对芬戈莫德,东阳光药业算得上较早布局仿制的国内药企之一。2014年,东阳光向美国FDA申报首仿。2019年12月,也就是在化合物专利到期10个月之后,FDA批准了东阳光的芬戈莫德口服胶囊仿制药的申请。同一批获准仿制的企业还有印度的比康制药(Biocon)、太阳制药(Sun Pharmaceutical)。
在国内,2020年2月,东阳光的盐酸芬戈莫德胶囊的上市申请获得CDE承办,成为该品种内国内首家报产企业。但目前东阳光的申请处于暂停状态。
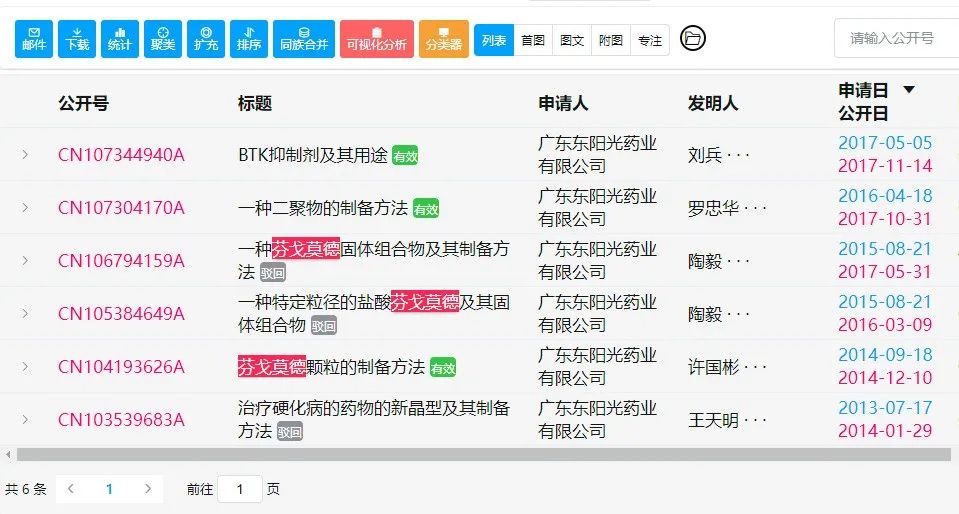
从国内专利布局上看,以“芬戈莫德”为全文关键词,笔者检索到以上6件专利。其中,2件芬戈莫德组合物专利、1件涉及晶型与制备方法的专利已被驳回。
虽然东阳光已经拿到了美国仿制药的批文,但根据美国专利挑战制度基本逻辑,这只是完成了仿制药上市历程中的一环。
要想让自家的芬戈莫得仿制药在市面上拔得头筹,东阳光不仅需要密切关注其他仿制药企的的申报进展与研发情况,还要在后续的药品研发上规避或直接无效掉诺华在橙皮书上已公开的相关药品专利。
针对诺华0.5mg规格的盐酸芬戈莫得胶囊,除了405号专利,摆在东阳光等仿制药企面前的还有一道“防线”——US10,543,179(下称179号专利)。结合上文关于芬戈莫德药品专利布局的描述,在目前的情势下,179号专利是保障诺华芬戈莫德维持排他性竞争的关键。
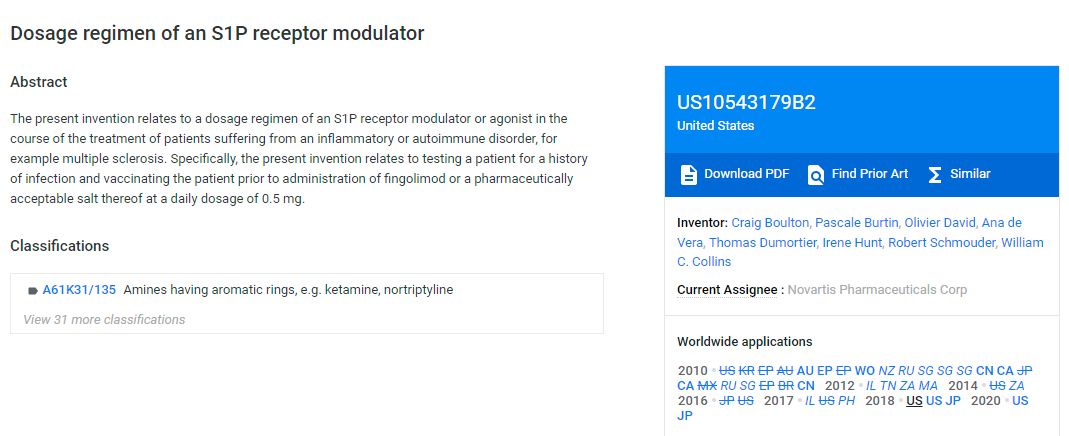

(US10,543,179, source: Google Patent)
179号专利是一件给药方法专利,优先权日为2018年5月23日,将于2027年12月到期。
这件专利的四项权利要求,描述了一种治疗可能有感染水痘带状疱疹病毒感染风险的RRMS(复发缓解型多发性硬化)患者的方法。另,芬戈莫德的说明书中提到“在开始使用 GILENYA 之前,测试患者的水痘带状疱疹病毒 (VZV) 抗体;建议在开始使用 GILENYA 治疗之前对抗体阴性患者进行 VZV 疫苗接种”。
为了获得这件专利权,诺华与美国专利局“较量”了几个来回。核心争议是这件专利是否具有显而易见性。最终,审查员认为,现有技术没有教导给未患水痘的患者接种水痘疫苗可以降低感染水痘的风险,即该专利申请不具有显而易见性,可以获得授权。
诺华在提交的论点中认为,是它提出了在给予芬戈莫德之前为患者接种水痘疫苗的想法。作为进一步的证明,诺华表示,其他 DMT(疾病修正治疗 )并未遵循这种在给药前建议接种疫苗的范式。[Reference: App. 15/986,992, Agenda for Examiner Interview, Oct. 2, 2019]
值得一提的是,这件专利既没有公开任何数据,也没有临床试验、测试或者关于本发明的证据。对于东阳光等仿制药企来说,要想成功挑战或者规避这件专利,并不容易。
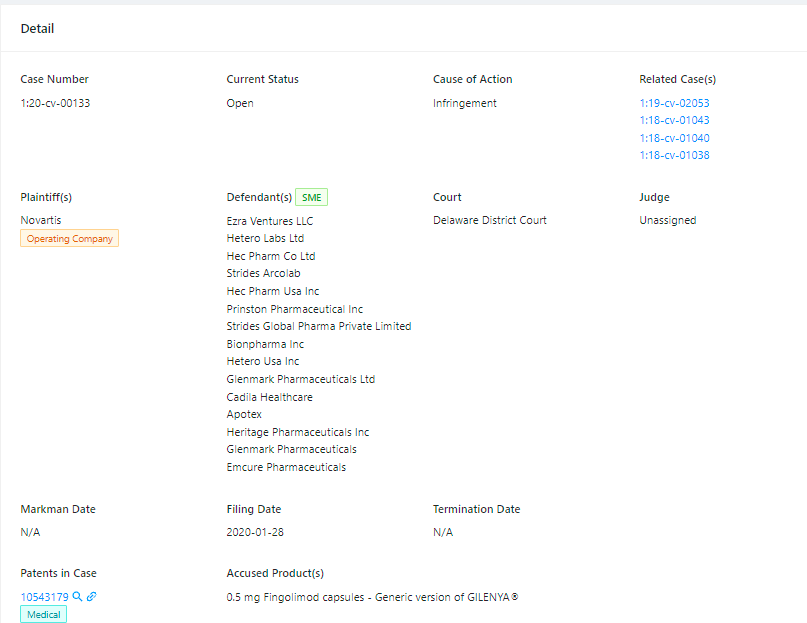
(Case Number: 1:20-cv-00133,source: Unified Patent)
围绕179号专利,诺华已向包括东阳光药业在内的多家仿制药企提起诉讼,主张在该专利到期之前,诺华有权享有的任何延长或额外的排他期。目前,系列诉讼未有最终定论。
最终,哪家申报的芬戈莫德仿制可以在美首先问世,我们且行且看。相关案件的进展,知产力MED+将持续关注。
扫描下方二维码,留言姓名+单位+芬戈莫德
即可获取本文所涉部分诉讼文书

部分参考资料:
[1] Generic Drugmakers Score Big in Rare Federal Circuit Reversal June 23, 2022 https://news.bloomberglaw.com/ip-law/generic-drugmakers-score-big-in-rare-federal-circuit-reversal
[2] If You Can’t Describe It, You Can’t Patent It!May 24, 2019,https://www.jdsupra.com/legalnews/if-you-can-t-describe-it-you-can-t-87284/
[3] Pharma Patents: New Insights To Satisfy Written Description For Claimed Ranges,April 11, 2022,https://www.outsourcedpharma.com/doc/pharma-patents-new-insights-to-satisfy-written-description-for-claimed-ranges-0001
[4] CAR-T专利不满足”充分描述”标准,朱诺医疗(Juno)无缘12亿美元赔偿
[5] 多发性硬化症,百度健康医典
[6]药品开发策略:突破晶型专利,做改良型创新药 ——以芬戈莫德为例 https://zhuanlan.zhihu.com/p/376618379
[7] Novartis faces threat of early generic of MS drug Gilenya in US,https://pharmaphorum.com/news/novartis-faces-threat-of-early-generic-of-ms-drug-gilenya-in-us/
[8]1:21-cv-01530 - Novartis v. Hec Pharm Usa Inc et al.https://portal.unifiedpatents.com/litigation/Delaware%20District%20Court/case/1:21-cv-01530
[9]The Balance Between Obviousness and Written Description — Lessons Learned from Recent Decisions,https://katten.com/the-balance-between-obviousness-and-written-description-lessons-learned-from-recent-decisions#:~:text=
'%20'The%20essence%20of%20the%20written,v.
[10]隆诺视界|药物化合物专利挑战实务问题概述(一)
[11]Can Novartis’ new chicken-pox patent protect Gilenya from generic competition?
https://www.markmanadvisors.com/blog/2020/2/13/can-novartis-new-chicken-pox-patent-protect-gilenya-from-generic-competition
[12]美国FDA首仿药制度及专利挑战策略
https://www.medicilon.com.cn/hang-ye-zi-xun/201711093643.shtml
[13]Novartis Loses Upper Hand In Patent Dispute Over $2.7B MS Drug | BioSpacehttps://www.biospace.com/article/novartis-loses-upper-hand-in-gilenya-patent-dispute-versus-generic-drug-maker/
[14]Federal Circuit Protects Novartis Gilenya Patent From Obviousness-Type Double Patenting,https://www.foley.com/en/insights/publications/2018/12/federal-circuit-protects-novartis-gilenya-patent-f
[15]国内10余家药企布局多发性硬化领域 多数为仿制
https://baijiahao.baidu.com/s?id=1734253491118140604&wfr=spider&for=pc

END
知产力医药频道征稿启事
知产力医药频道——“知产力MED+”,系知产力自媒体矩阵旗下公众号,拟聚焦医药行业创新研发、商业合规、知识产权保护、药品上市审批监管等行业热点问题,持续输出专业、及时的理论与实务文章,以飨读者。
征稿要求:
1.题材、体裁和篇幅:来稿应当围绕医药领域知识产权保护、商业合规或药品监管等相关题材展开,涉及创新研究成果、当下热点话题、能引起读者讨论和共鸣者尤佳。体裁不限,篇幅在2000-5000字之间为宜。不接受含有观点偏激、不合逻辑、语无伦次、涉及保密或隐私,或其他不宜公开发表内容的稿件。
2. 文件格式:请务必以Word文档格式(.docx或.doc)发送。3. 投稿方式:(1)电子邮箱:tougao@zhichanli.com,请在邮件标题中注明“医药投稿”。(2)微信:添加知产小管家(18611183071或ip_butler)为朋友可快速投稿。
请在邮件正文、稿件正文等处注明作者、单位、职务、联系方式(手机号及微信号)等信息。
4. 来稿应为原创作品,并许可知产力MED+公众号独家首发,不接受一稿多投。稿件发布之后,知产力公众号转发文章。您通过上述邮箱等渠道向知产力投稿,即视为您确认您本人为所投稿件著作权人及/或依法可以行使该稿件著作权的合法权利人,保证所投稿件为未公开发表过的原创作品,且同意许可知产力媒体矩阵(各类公众平台账号及/或网站上)发表或转载该文章,同意知产力授权第三方微信公众号或网站转载等。编辑会及时告知您稿件是否采纳,5个工作日内未获得回复可另投他处。
(图片来源 | 网络)



















